Libéthénite
La libéthénite est un minéral composé de phosphate de cuivre hydraté de formule Cu2PO4(OH). Elle fait partie du groupe de l'olivénite.
| Libéthénite Catégorie VIII : phosphates, arséniates, vanadates[1] | |

| |
| Général | |
|---|---|
| Classe de Strunz | 8.BB.30
|
| Classe de Dana | 41.06.06.02
|
| Formule chimique | Cu2PO4(OH) |
| Identification | |
| Masse formulaire[2] | 239,071 ± 0,008 uma H 0,42 %, Cu 53,16 %, O 33,46 %, P 12,96 %, |
| Couleur | vert olive foncé |
| Classe cristalline et groupe d'espace | dipyramidale, Pnnm |
| Système cristallin | orthorhombique |
| Échelle de Mohs | 4 |
| Propriétés chimiques | |
| Densité | 3,6-3,8 |
| Unités du SI & CNTP, sauf indication contraire. | |
Historique de la description et appellations
La libéthénite a été trouvée au XIXe siècle au cours de l’exploitation de filons de minerais de cuivre à Libethen (Empire austro-hongrois), actuellement Ľubietová en Slovaquie.
Caractéristiques physico-chimiques
Cristallochimie
La libéthénite fait partie du groupe de l'olivénite.
Cristallographie
|
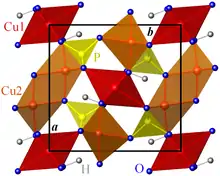
La libéthénite cristallise dans le système cristallin orthorhombique, de groupe d'espace Pnnm (Z = 4 unités formulaires par maille conventionnelle)[3].
Les cations P5+ sont en coordination tétraédrique d'anions O2− avec une longueur de liaison P-O moyenne de 1,537 Å. |
Les cations Cu2+ sont distribués sur deux sites non-équivalents : Cu1 et Cu2. Cu1 est en coordination (2+4) octaédrique déformée d'O2− et de groupes hydroxyles OH avec quatre liaisons Cu1-O courtes (longueur de liaison moyenne 1,971 Å) et deux liaisons Cu1-O longues (2,394 Å). Cette distribution des longueurs de liaison dans les octaèdres Cu1O4(OH)2 est typique de l'effet Jahn-Teller rencontré dans les composés de Cu(II) et permet une description alternative de la structure en termes de groupes plans carrés Cu1O2(OH)4. Cu2 est en coordination (4+1) trigonale bipyramidale déformée d'O2− et d'OH avec une longueur de liaison Cu2-O moyenne de 2,002 Å.
Les groupes Cu1O2(OH)4 sont reliés entre eux par leurs arêtes et forment des chaînes CuO(OH) le long de la direction c. Les groupes Cu2O4(OH) sont reliés par une arête et forment des dimères Cu2O6(OH)2 ; ils sont reliés aux chaînes CuO(OH) par un groupe hydroxyle des plans carrés Cu1O2(OH)4 et, plus faiblement, par un atome d'oxygène formant les liaisons longues des octaèdres Cu1O4(OH)2.
Propriétés chimiques
- La libéthénite agit comme un puissant catalysateur dans les réactions d'oxydo-réduction[4].
- À partir de 500 °C, la libéthénite montre des signes de déshydratation ; en particulier, son coefficient de dilatation thermique le long de la direction c devient négatif. Au-dessus de 580 °C, la libéthénite est entièrement décomposée en Cu4(PO4)2O + H2O[4] - [5].
Propriétés physiques
En dessous de 110 K, la libéthénite présente un gap de spin : les moments magnétiques des ions Cu2+ ne sont pas ordonnés dans l'état fondamental, même à proximité du zéro absolu. Les interactions magnétiques dominantes sont celles entre les dimères Cu2O6(OH)2 et les chaînes CuO(OH)[6].
Notes et références
- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ICSD No. 200 422 ; (en) A. Cordsen, « A crystal-structure refinement of libethenite », The Canadian Mineralogist, vol. 16, no 2, , p. 153-157
- (en) F.-S. Xiao, J. Sun, X. Meng, R. Yu, H. Yuan, J. Xu, T. Song, D. Jiang et R. Xu, « Synthesis and structure of copper hydroxyphospate and its high catalytic activity in hydroxylation of phenol by H2O2 », Journal of Catalysis, vol. 199, no 2, , p. 273-281 (DOI 10.1006/jcat.2001.3166)
- (en) M. Zema, S.C. Tarantino et A.M. Callegari, « Thermal behaviour of libethenite from room temperature up to dehydration », Mineralogical Magazine, vol. 74, no 3, , p. 553-565 (DOI 10.1180/minmag.2010.074.3.553)
- (en) A.A. Belik, H.-J. Koo, M.-H. Whangbo, N. Tsujii, P. Naumov et E. Takayama-Muromachi, « Magnetic properties of synthetic libethenite Cu2PO4OH: a new spin-gap system », Inorganic Chemistry, vol. 46, no 21, , p. 8684-8689 (DOI 10.1021/ic7008418)