Gramicidine
La gramicidine est un mélange d'antibiotiques, aussi nommé gramicidine D d'après René Dubos qui découvrit ce peptide à la fin des années 1930. Ce mélange est composé de gramicidine A (80 %), B (6 %) et C (14 %), et est isolé dans la bactérie Bacillus brevis. C'est un pentadécapeptide composé de 15 acides aminés que l'on retrouve sous forme de chaine linéaire, contrairement à la gramicidine S cyclique. La gramicidine est considérée comme le premier antibiotique naturel découvert et commercialisé.
| Gramicidine | |
| |
| Identification | |
|---|---|
| Synonymes |
Bacillus brevis gramicidin D |
| No CAS | |
| No ECHA | 100.014.355 |
| No CE | 215-790-4 |
| Code ATC | R02 |
| DrugBank | BTD00036 |
| InChI | |
| Propriétés chimiques | |
| Formule | C99H140N20O17 [Isomères] |
| Masse molaire[1] | 1 882,294 7 ± 0,098 1 g/mol C 63,17 %, H 7,5 %, N 14,88 %, O 14,45 %, |
| Propriétés physiques | |
| Solubilité | 5×10−7 mol·l-1[2] |
| Précautions | |
| Directive 67/548/EEC | |
 Xn |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
En 1939, le microbiologiste franco-américain René Dubos isole la tyrocidine[3] - [4], et démontre ensuite avec Rollin D. Hotchkiss que cette substance est un mélange composé de tyrocidine et de gramicidine[5] - [6] - [7].
Bien que des injections intrapéritonéales sur des souris aient montré que celles-ci étaient protégées contre des infections bactériennes fatales, la gramicidine D est toxique lorsqu'elle est administrée par voie intraveineuse, et ne peut donc être utilisée pour traiter des infections systémiques. Néanmoins, la gramicidine D fut utilisée comme pommade durant la Seconde Guerre mondiale pour traiter des blessures et des ulcères et est encore utilisée dans certaines préparations[8].
Au cours de sa quatrième année d'étude en chimie à l'université d'Oxford (1946-1947), Margaret Thatcher travaille sur la cristallisation de la gramicidine B, sous la direction de Dorothy Hodgkin (prix Nobel de chimie en 1964)[9].
Structure
Structure primaire
Les gramicidines se présentent sous la forme de pentadécapeptides linéaires, de masse molaire d'environ 1 900 g·mol−1. La structure primaire est constituée de 15 acides aminés, alternant les conformations L- et D-, avec un groupement formyl en position N-terminale et une fonction alcool en position C-terminale[10] :
Dans le mélange gramicidine D, l'espèce prédominante est la gramicidine A (80 %), où l'acide aminé en position 11 (dénoté X dans la séquence) se trouve être un résidu L-Trp. Les gramicidines B et C présentent elles respectivement des résidus L-Phe et L-Tyr en position 11. De plus, il faut noter qu'en position 1, le résidu L-Val est remplacé par le L-Ile dans 5 à 20 % des molécules.
Cette séquence est l'une des plus hydrophobes connues[11], et par conséquent la solubilité dans l'eau de la gramicidine est très faible, de l'ordre de 5×10−7 mol·l-1[2].
Structure secondaire
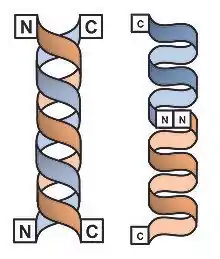
La particularité de l'alternance d'acides aminés L- et D- dans la structure primaire de la gramicidine implique une grande sensibilité quant à l'environnement dans lequel est placé le peptide. Deux formes principales ont été observées : la forme dimérique en simple hélice et la forme dimérique en double hélice :
- Dans la forme double hélice, les deux chaînes polypeptidiques forment entre elles une série de liaisons hydrogène intermoléculaires sur toute la longueur des chaînes (sous la forme de feuillets bêta parallèles ou antiparallèles) et sont enroulées sous forme d'hélice. Cette structure est décrite comme structure ππ5,6 ou ππ6,4 (l'exposant indiquant le nombre d'acides aminés par tour dans chaque hélice monomérique). La version antiparallèle de la double hélice est désignée comme étant la forme poreuse[12] ;
- Dans la forme simple hélice, chacune des deux chaînes polypeptidiques forment aussi des liaisons hydrogène, mais principalement de manière intramoléculaire. Les acides aminés en position N-terminale forment six liaisons hydrogène intermoléculaires qui permettent d'associer les deux monomères[13]. Cette structure est décrite comme structure ββ6,3 (de même que précédemment, l'exposant indiquant le nombre d'acides aminés par tour dans chaque hélice monomérique). Cette forme est désignée comme étant la forme canal[12]. Le diamètre de ce canal est de l'ordre de 4 Å, et la longueur du dimère atteint 26 Å, du même ordre de grandeur que la partie hydrophobe de la bicouche lipidique de la membrane plasmique[14].
Mode d'action
Les gramicidines linéaires sont une famille d'antibiotiques de type porine dont l'activité antibactérienne s'exerce par l'augmentation de la perméabilité cationique de la membrane plasmique de la bactérie cible[15]. Cette perméabilité est due à la formation de canaux au travers de la bicouche lipidique[16], du fait de la structure en hélice de la gramicidine dimérique.
Activité antibactérienne
La gramicidine est active contre les bactéries à gram positif, excepté la bactérie Bacilli, et contre les organismes à gram négatif, comme les bactéries Neisseria. Cette activité antibactérienne est utilisée comme antimicrobien, antimycosique et antiprotozoaire (en), et ce depuis sa découverte[6]. Divers agents pathogènes de maladies sexuellement transmissibles comme Neisseria gonorrhoeae, Candida albicans et Chlamydia trachomatis sont connus pour être sensibles à cet antibiotique.
Utilisation clinique
Bien que d'un intérêt limité de nos jours, la gramicidine fut le premier antibiotique naturel découvert et commercialisé[8]. La gramicidine n'irrite pas les muqueuses et est peu absorbée à travers la peau.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) G. Kemp, K. A. Jacobson et C. E. Wenner, « Solution and interfacial properties of gramicidin pertinent to its effect on membranes », Biochim. Biophys. Acta, Biomembr., vol. 255, no 2, , p. 493-501 (ISSN 0005-2736, DOI 10.1016/0005-2736(72)90153-8)
- (en) R. J. Dubos, « Studies on a bactericidal agent extracted from a soil bacillus I. Preparation of the agent. Its activity in vitro », J. Exp. Med., vol. 70, no 1, , p. 1-10 (ISSN 1540-9538, DOI 10.1084/jem.70.1.1, lire en ligne)
- (en) R. J. Dubos, « Studies on a bactericidal agent extracted from a soil bacillus II. Protective Effect of the Bactericidal Agent against Experimental Pneumococcus Infections in Mice », J. Exp. Med., vol. 70, no 1, , p. 11-17 (ISSN 1540-9538, DOI 10.1084/jem.70.1.11, lire en ligne)
- (en) R. D. Hotchkiss et R. J. Dubos, « Bactericidal Fractions from an Aerobic Sporulating Bacillus », J. Biol. Chem., vol. 136, no 3, , p. 803-804 (ISSN 0021-9258, lire en ligne)
- (en) R. J. Dubos et R. D. Hotchkiss, « The Production of Bactericidal Substances by Aerobis Sporulating Bacilli », J. Exp. Med., vol. 73, no 5, , p. 629-640 (ISSN 1540-9538, DOI 10.1084/jem.73.5.629, lire en ligne)
- (en) R. D. Hotchkiss et R. J. Dubos, « The Isolation of Bactericidal Substance from Cultures of Bacillus brevis », J. Biol. Chem., vol. 141, no 1, , p. 155-162 (ISSN 0021-9258, lire en ligne)
- (en) H. L. Van Epps, « René Dubos: unearthing antibiotics », J. Exp. Med., vol. 203, no 2, , p. 259 (ISSN 1540-9538, DOI 10.1084/jem.2032fta, lire en ligne)
- (en) Margaret Thatcher, The path to power, New York, HarperCollins, , 656 p. (ISBN 0-06-092732-1), p. 39
- (en) R. Sarges et B. Witkop, « Gramicidin A. V. The Structure of Valine- and Isoleucine-gramicidin A », J. Am. Chem. Soc., vol. 87, no 9, , p. 2011-2020 (ISSN 0002-7863, DOI 10.1021/ja01087a027)
- (en) J. P. Segrest et R. J. Feldmann, « Membrane proteins: Amino acid sequence and membrane penetration », J. Mol. Biol., vol. 87, no 4, , p. 853-858 (ISSN 0022-2836, DOI 10.1016/0022-2836(74)90090-4)
- (en) B. A. Wallace, « Recent Advances in the High Resolution Structures of Bacterial Channels: Gramicidin A », J. Struct. Biol., vol. 121, no 2, , p. 123-141 (ISSN 1047-8477, DOI 10.1006/jsbi.1997.3948)
- (en) A. M. O'Connell, R. E. Koeppe et O. S. Andersen, « Kinetics of gramicidin channel formation in lipid bilayers: transmembrane monomer association », Science, vol. 250, no 4985, , p. 1256-1259 (ISSN 0036-8075, DOI 10.1126/science.1700867)
- (en) J. A. Killian, « Gramicidin and gramicidin–lipid interactions », Biochim. Biophys. Acta, Biomembr., vol. 1113, , p. 391–425 (ISSN 0005-2736)
- (en) F. M. Harold et J. R. Baarda, « Gramicidin, Valinomycin, and Cation Permeability of Streptococcus faecalis », J. Bacteriol., vol. 94, no 1, , p. 53-60 (ISSN 0021-9193, lire en ligne)
- (en) S. B. Hladky et D. A. Haydon, « Discreteness of Conductance Change in Bimolecular Lipid Membranes in the Presence of Certain Antibiotics », Nature, vol. 225, no 5231, , p. 451-453 (ISSN 0028-0836, DOI 10.1038/225451a0)
- (en) A. S. Bourinbaiar et S. Lee-Huang, « Comparative in vitro study of contraceptive agents with anti-HIV activity: Gramicidin, nonoxynol-9, and gossypol », Contraception, vol. 49, no 2, , p. 131-137 (ISSN 0010-7824, DOI 10.1016/0010-7824(94)90088-4)
- (en) A. S. Bourinbaiar et C. F. Coleman, « The effect of gramicidin, a topical contraceptive and antimicrobial agent with anti-HIV activity,against herpes simplex viruses type 1 and 2 in vitro », Arch. Virol., vol. 142, no 11, , p. 2225-2235 (ISSN 0304-8608, DOI 10.1007/s007050050237)