Extraction de l'alumine
L’extraction de l’alumine est un procédé chimique qui permet d’extraire l’oxyde d’aluminium appelé alumine contenu dans la bauxite. L’alumine est la principale matière première qui permettra la fabrication de l’aluminium métal par un procédé d'électrolyse.
La mise au point du procédé a été faite au cours de la deuxième moitié du XIXe siècle. Plusieurs procédés ont été élaborés : le procédé Deville, le procédé Peniakoff Sapeck, le procédé Petersen Haglund. C’est finalement le procédé inventé par Karl Josef Bayer qui sera universellement utilisé. Le procédé Orbite semble offrir une alternative moins polluante au procédé Bayer, mais doit faire ses preuves dans l'industrie.
Le procédé Deville
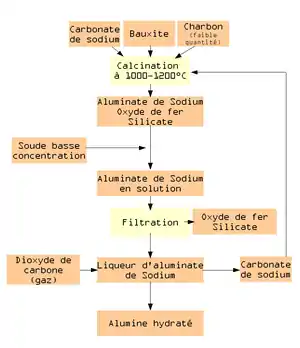
Ce procédé a été inventé en 1860 par Henri Sainte-Claire Deville. Il a été breveté sous le nom de Louis Le Chatelier (brevet français no 37682, )[1]. Il est souvent appelé « procédé Deville Pechiney ». Il est basé sur l'extraction de l'alumine contenu dans la bauxite par du carbonate de sodium[2].
La première opération consiste à calciner à 1 200 °C un mélange de bauxite broyé avec du carbonate de sodium et un peu de charbon. L'alumine se transforme en aluminate de sodium. L'oxyde de fer reste inchangé et la silice forme un silicate double. Par addition de soude (NaOH), il y a dissolution de l’aluminate de sodium alors que les autres composés restent sous forme solide. La quantité de soude utilisée dépend de la quantité de silice contenue dans le minerai.
Par filtration, on sépare la liqueur d’aluminate de sodium des autres corps. On fait barboter du dioxyde de carbone gazeux dans la liqueur afin de précipiter de l’alumine hydratée et de reconstituer du carbonate de sodium. Ce dernier peut être réutilisé.
L’alumine hydratée est ensuite calcinée pour obtenir de l’alumine.
Ce procédé a été largement utilisé en France dans l’usine de Salindres jusqu’en 1923. En Grande-Bretagne et en Allemagne, ce procédé a été utilisé jusqu’à la Seconde Guerre mondiale[2].
Procédé Bayer
Le procédé
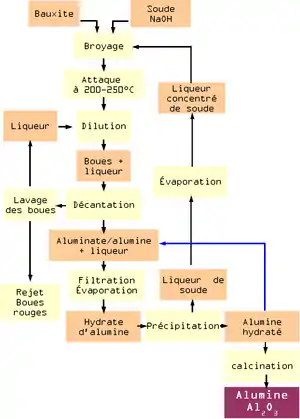
Il a été mis au point par Karl Josef Bayer en 1887 afin d'extraire l'alumine provenant de la bauxite. Le procédé est basé sur (i) la dissolution à chaud de l'alumine contenue dans la bauxite à l'aide de soude, (ii) l'élimination des impuretés par décantation, (iii) la re-précipitation d'un hydrate d'alumine purifié lors du refroidissement, (iv) l'obtention de l'alumine après calcination[3].
Dans la bauxite, l’alumine (Al2O3) est présente sous forme de monohydrate Al2O3·(H2O) dans la boehmite ou le diaspore, et de trihydrate Al2O3·(H2O)3 dans la gibbsite. À 150-200 °C, l'alumine de ces minéraux est dissoute par les ions hydroxyde basiques de la soude selon l'équation suivante[4] :
- Al2O3 + 2NaOH → 2 NaAlO2 + H2O.
Pour être efficace, la décomposition demande la présence d’hydrate d’alumine fraîchement extrait.
Les impuretés autres que la silice (oxyde de fer, hydroxyde de fer, silice, etc.) restent insolubles dans la soude, et sont séparées de la liqueur d’alumine par décantation et filtration, formant un déchet appelé la boue rouge[4]. Ce déchet très alcalin riche en hydroxyde de sodium est considéré toxique. Le silicium est éliminé par la suite, lorsqu'il précipite à nouveau[4].
En refroidissant et en diluant la liqueur, de la gibbsite purifiée précipite. Le trihydrate d'alumine est alors calciné entre 1010 et 1 260 °C afin d'en extraire l'alumine[4] :
- .
Un procédé toujours utilisé
Le démarrage est difficile. Il ne deviendra réellement viable qu’en 1907. Le passage des travaux de laboratoire à la réalisation industrielle pose de nombreux problèmes.
En France, l’usine qui utilisera la première ce procédé est l’usine de Gardanne à partir de 1894. Karl Bayer viendra aider au démarrage de l’usine. Malgré sa présence, la production n’atteint pas les espérances[5]. Il faudra de nombreux perfectionnements avant d'obtenir les rendements espérés.
Le procédé Bayer détrônera les autres méthodes de production de l'alumine à partir de la bauxite. Il est toujours utilisé aujourd'hui.
Le procédé Orbite
Le procédé Orbite a été breveté initialement par l'entreprise canadienne Orbite Technologies en 2008[6]. Il est présenté comme moins énergivore et moins polluant, et censé remplacer le procédé Bayer. Il permettrait aussi de valoriser les boues rouges issues du procédé Bayer. Ce procédé n'a cependant jamais été industrialisé.
Le procédé
Le procédé Orbite peut être divisé ainsi : la préparation du minerai, la lixiviation, l’extraction de l’alumine, l’extraction du fer, et finalement la calcination. Le procédé intègre également un système de régénération de l'acide utilisé (pertes minimes). Le minerai (le procédé a été conçu au départ pour les argiles alumineuses) doit être broyé pour produire de fines particules. Cette étape permet de maximiser la surface de contact. Ensuite, on procède à la « lixiviation » qui consiste à lessiver le minerai à très haute température avec de l'acide chlorhydrique (HCl), ce qui a pour effet de dissoudre tous les atomes des métaux contenus dans l'argile alumineuse et dans les boues rouges en molécules chlorurées en solution (à l'exception du groupe IVB; titane, zirconium et hafnium et du groupe IVA; germanium et étain si l'oxygène est assez abondant). L’alumine et le fer forment respectivement du trichlorure d’aluminium AlCl3 et du chlorure de fer FeCl3. La silice dioxyde de silicium ainsi que les dioxydes, hydroxydes et silicates de titane, zirconium, hafnium, germanium et l'étain, sont retirés par filtration et constituent le seul déchet du procédé à ce stade[7].
Du « lixiviat », le mélange restant, le trichlorure d’aluminium est précipité sous forme d'hexahydrate d'alumine. La calcination à très haute température le transforme en alumine. Le chlorure de fer qui reste dans le lixiviat, est ensuite soumis à une hydrolyse à basse température, précipitant de l'oxyde de fer très pur, tout en régénérant de l’acide chlorhydrique. Il ne reste alors dans le lixiviat que des ions métalliques en solution : du magnésium, du gallium, des alcalins et des terres rares récupérables par les méthodes d'extractions habituelles. Le procédé ne produit pas de boue rouge ni de déchet acide. Orbite Aluminae a démontré que le procédé fonctionne sur diverses argiles alumineuses, sur la bauxite de qualité très variée, la néphéline, le kaolin, les cendres volantes provenant du charbon, et les boues rouges. Cette dernière application fait du procédé Orbite une méthode de traitement des déchets des alumineries utilisant le procédé Bayer[8].
Bibliographie
- Philippe Voisin in « Métallurgie extractive de l'aluminium », Techniques de l'ingénieur, traité matériaux métalliques, M2 340.
- G. A. Baudart in « Histoire française de l'alumin », Revue de l'aluminium, no 217, janvier 1955, page 35.
- (en) Encyclopædia Britannica, « Bayer process », sur www.britannica.com (consulté le )
- (en) « Manufacturing of alumina through Bayer process », sur www.worldofchemicals.com (consulté le )
- Olivier Raveux in « Les débuts de l'alumine à Gardanne (1892 - 1899) », Cahiers d'histoire de l'aluminium, no 13, hiver 1993 - 1994, page 7
- Brevet US 7837961 « Processes for extracting aluminum and iron from aluminous ores », déposé le 7 mai 2008, expiré le 31 décembre 2018.
- https://www.google.com/patents/WO2012065253A1?cl=en&dq=inassignee:%22Orbite+Aluminae+Inc.%22&hl=en&sa=X&ei=-VMFU_3eFum9yAHFy4CIAg&ved=0CGYQ6AEwBw., consulté le 19 février 2014
- « Procédé de remédiation des boues rouges et de récupération des minéraux d'Orbite »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
