Extracellular signal-regulated kinases
Les protéines ERK1/2 sont des enzymes, des kinases, qui ajoutent des groupements phosphate à d'autres protéines afin de les activer. ERK1/2 font partie de la famille des MAP kinases qui sont des protéines jouant un rôle dans la division, la croissance et la prolifération cellulaires.
Généralités
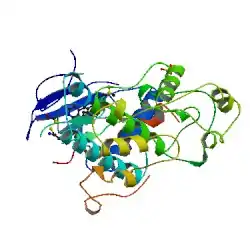
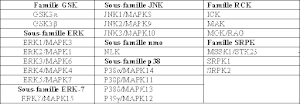
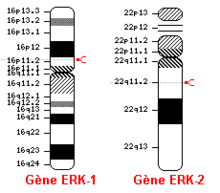
Les protéines ERK-1 et ERK-2 signifiant Extracellular signal-regulated kinases sont des protéines codées par les gènes 16p11.2 pour ERK-1 et 22p11.2 pour ERK-2. Ce sont deux isoformes respectivement de poids moléculaires de 43 kDa (379 acides aminés) et 41 kDa (360 acides aminés) chez l’humain. Quand ces protéines deviennent phosphorylées, elles acquièrent un poids moléculaire de 44 kDa et 42 kDa respectivement pour ERK-1 et pour ERK-2. Bien que ERK-1 et ERK-2 possèdent plusieurs autres noms (voir tableau 1[1]), les chercheurs les nomment couramment ERK1/2. Ces deux enzymes ont un degré d’homologie de 83 %, car on remarque une similitude dans la séquence et la composition de leurs acides aminés. ERK1/2 sont des kinases qui sont activées par l’ajout obligatoire de deux groupements phosphate à une thréonine (T) et à une tyrosine (Y). Ces protéines kinases ajoutent elles aussi un ou des groupement(s) phosphate à des endroits spécifiques, particulièrement sur des résidus tyrosine, thréonine ou sérine pour activer à leur tour d’autres protéines. ERK1/2 font partie de la famille des MAP kinases, mitogen-activated protein kinases (voir tableau 2[2]).
Pendant les années 1990, la compréhension sur le fonctionnement de la cascade de signalisation des MAP kinases impliquant ERK1/2 était déjà bien établie et relativement bien comprise et les recherches sur ces deux protéines sont encore d’actualité, puisque ces protéines ont un rôle important dans la plupart des organismes vivants.
TABLEAU 1 : dénominations des protéines ERK-1 et ERK-2
| ERK-1 | ERK-2 |
|---|---|
| Mitogen-activated protein kinase 3 | Mitogen-activated protein kinase 1 |
| Extracellular signal-regulated kinase 1 (ERK-1) | Extracellular signal-regulated kinase 2 (ERK-2) |
| MAP kinase 1 (MAPK 1) | MAP kinase 2 (MAPK 2) |
| Microtubule-associated protein 2 kinase | Mitogen-activated protein kinase 2 |
| p44-ERK1 | p42-MAPK |
| ERT2 | ERT1 |
| MNK1 | |
Fonctions
Les MAP kinases ont un rôle important à jouer dans la croissance, la prolifération et la différenciation cellulaires; elles sont également «des régulateurs ubiquitaires»[3] (se retrouvent dans pratiquement tous les types de cellule de l’organisme). Le signal de transduction engendré par diverses molécules (facteurs mitogènes, stimuli de différenciation et cytokines) active en bout de ligne ERK1/2 qui phosphorylent plusieurs substrats cytoplasmiques et nucléaires nécessaires à la transcription de nombreux gènes afin de passer de la phase G1 à la phase S dans le processus de division cellulaire[4] - [5] (Voir figure 2). On retrouve ERK1/2 chez plusieurs organismes, notamment chez les levures, chez les eucaryotes, chez les grenouilles et chez les mammifères où ces protéines ont été étudiées. Chez ces organismes, cette voie de signalisation, Ras-dependent extracellular signal-regulated kinase (ERK)1/2 mitogen-activated protein (MAP) kinase pathway, est évolutivement bien conservée et possède les mêmes fonctions. De plus, il est possible de remarquer que cette voie a été adaptée à différentes fins. Ainsi, les levures utilisent la voie de signalisation des MAP kinases ERK1/2 pour répondre lors de stimuli, comme les phéromones, pendant la période de reproduction sexuée. Une levure prolongera alors ses hyphes afin de rejoindre les hyphes de l’autre levure afin de se reproduire de façon sexuée. Il y a aussi les petites mouches à fruits (drosophiles) qui utilisent cette voie de transduction pour la différenciation des photorécepteurs de la rétine. Les plantes à fleurs, quant à elles, initient une défense contre les pathogènes grâce au signal reçu par cette voie de signalisation[6].
Voie de signalisation impliquant ERK1/2
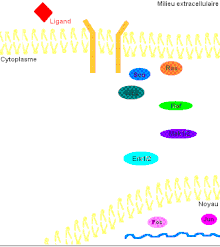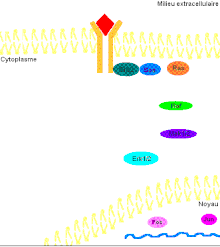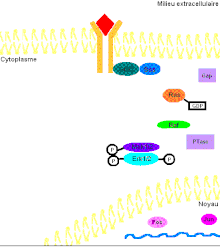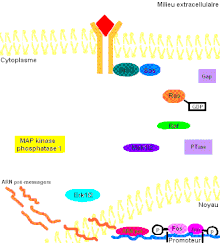
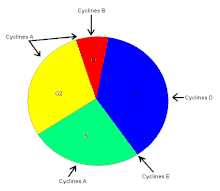
Pour mieux comprendre les effets de ERK1/2 dans l’organisme, il faut connaître de prime abord les détails de la voie de signalisation Ras-dépendante ERK1/2 MAP kinase. En premier lieu, un ligand vient se lier à un récepteur tyrosine kinase. Cette liaison provoque la dimérisation des deux monomères de ce type de récepteur, notamment les récepteurs EGF (epidermal growth factor) et PDGF (Platelet-derived growth factor), entraînant alors une autophosphorylation du récepteur (besoin d’ATP pour cela). Ensuite, la protéine adaptatrice Grb2, qui possède des domaines SH2 et SH3, s’accroche au récepteur tyrosine kinase par son domaine SH2 au résidu phosphotyrosine du récepteur, tandis que les deux domaines SH3 se fixent aux résidus de proline de la protéine adaptatrice Sos. Puis, Grb2-Sos entre en contact avec Ras qui se situe dans le cytosol, près de la membrane plasmique. Ras, cette petite protéine G d’une seule sous-unité, devient sous sa forme active, chargée de GTP. Elle entre en interaction avec la protéine sérine/thréonine kinase Raf qui phosphoryle à son tour les MAP kinase kinases, MEK1/2. Cette cascade de phosphorylation se poursuit par l’activation des protéines d’intérêt ERK1/2 sur leurs résidus tyrosine et thréonine. Ainsi, ERK1/ 2 entrent ensuite dans le noyau cellulaire et ajoutent des groupements phosphate aux résidus sérine et thréonine du facteur de transcription Fos; le facteur de transcription Jun étant préalablement phosphorylé par la protéine kinase JNK (une autre protéine de la famille des MAP kinases). Ces deux facteurs de transcription forment alors un hétérodimère nommé complexe transcriptionnel AP-1 (activating protein-1) qui agit sur le gène c-Fos, un gène de réponse précoce (nécessaire pour passer de l’état G0 à G1 du cycle cellulaire). De plus, les facteurs de transcription de la famille ETS-domain, entre autres, Elk-1, SAP-1 et NET/ERP/SAP-2/ELK-3[7] sont des cibles de ERK1/2. De plus, à ce jour, 173 gènes anti-prolifératifs ont été identifiés comme étant des cibles de ERK1/2 qui les régulent négativement pendant la phase de division cellulaire G1. Entre autres, Tob qui fait partie de cette famille de gène antiprolifératif, empêchant la transcription des cyclines D1, est inactivé lorsqu’il est phosphorylé par ERK1/2. ERK1/2 ont également un effet direct sur les cyclines D, particulièrement les cyclines D1, dont le promoteur de celles-ci possède un site fonctionnel de liaison AP-1. On sait que les cyclines sont importantes pour le passage de la cellule de la phase G1 à la phase S. Ceci assurant donc le commencement de la division cellulaire. Tout récemment, les chercheurs ont découvert que ERK1/2 ont la capacité de phosphoryler, entre autres, la protéine kinase RSK. Cette dernière phosphoryle l’histone 3 sur la sérine 10. Les histones ont la possibilité de remodeler la chromatine[8] et rendre certaines sections du génome accessibles afin d’utiliser des gènes spécifiques pour la division cellulaire.
Il faut préciser que, dans une cellule normale, chaque protéine de la cascade est inactivée après un certain temps pour éviter leur activation constitutive. Or, la protéine kinase Ras sera désactivée par une protéine Gap (GTPase activator) qui sont des régulateurs dans cette voie de signalisation afin d’accélérer l’hydrolyse du GTP en GDP[9]. Pour ce qui est des protéines kinases, elles seront désactivées par les phosphatases (PTases) dont leur rôle est d’enlever les groupements phosphate. Précisément, la MAP kinase phosphatase-1 déphosphoryle les résidus tyrosine et thréonine de ERK1/2 (Voir la figure 3 pour une vue d'ensemble de la voie de signalisation Ras-dépendante ERK1/2 MAP kinase).
Pathologies associées
ERK1/2 se retrouvant dans la plupart des cellules de l’organisme et étant des protéines très importantes dans la différenciation, la prolifération et la croissance cellulaires, une surexpression ou une absence de leurs niveaux cause de très graves conséquences. En premier lieu, il faut comprendre ce qui se passe dans une cellule normale afin d’envisager les effets d’un dérèglement cellulaire. Lorsqu’il y a une surexpression ou une suractivation de ERK1/2 dans la cellule, les inhibiteurs p15 et p16 augmentent dans la cellule et engendrent alors l’arrêt du cycle cellulaire. Ce procédé a été étudié dans certains types de cellules tels les fibroblastes, les cellules de Schwann, les hépatocytes, les lymphocytes T, les kératinocytes, les astrocytes et les cellules épithéliales de l’intestin. Donc, ces inhibiteurs forment le mécanisme de protection mis en place pour éviter la prolifération cellulaire anormale causée par un signal mitotique trop fort et ainsi permet d’éviter la formation de cancers. Un dérèglement de ce mécanisme et l’activation constitutive de ERK1/2 causeront possiblement le développement d’une tumeur.
En deuxième lieu, une diminution ou même carrément l’absence de ERK1/2 provoque également des effets néfastes. En effet, une mutation sur le gène de ERK1 ou sur le gène de ERK2 entraîne, par exemple, une baisse de la prolifération des lymphocytes T en présence d’un agent infectieux, car les lymphocytes T possède le complexe AP-1 qui sert à la production d’interleukine-2 essentiel à la croissance de ceux-ci. Alors, le système immunitaire n’arrive plus à combattre normalement contre l’infection. De plus, des études faites chez la souris dont on avait injecté la toxine létale de l’anthrax, ont montré une perturbation dans la voie des MAP kinase des macrophages. Une façon subtile d’attaquer le système immunitaire et de survivre dans l’organisme. Par ailleurs, une autre étude menée sur des souris knock-out Erk1-/-, ne présente aucune anomalie dans la différenciation thymique, mais chez d’autres types de cellules comme les kératinocytes, on remarque une baisse de prolifération en réponse aux agents mitotiques. De plus, une déficience de ERK-1 diminue la progression du papillome de stade 2 induit par des produits chimiques sur la peau de la souris. Par contre, lorsqu’une délétion est faite dans le gène ERK-2, alors on remarque un blocage dans la maturation des thymocytes. Ce qui fait croire que ERK-1 n’arrive pas à compenser pour le manque de ERK-2. Pour continuer, chez des souris ayant eu un infarctus, la perte de leur allèle Erk2 provoque une augmentation de la mort des cellules cardiaques. Par conséquent, ERK1/2 sont des protéines importantes dans la survie cellulaire.
En conclusion, les effets individuels de ERK-1 et ERK-2 ne sont pas encore bien connus à ce jour. Mais il est évident que ERK-2 possède des effets sur le développement embryonnaire, car, chez la souris, si la protéine ERK-2 n’est pas présente, il y aura létalité embryonnaire après 7,5 jours. Le souriceau ne viendra jamais à terme. Il n’est pas possible de vérifier ces résultats chez l’humain pour des questions d’éthique. Il est impossible de pouvoir analyser tous les embryons humains morts afin de suspecter un lien avec ERK1/2. Bref, ERK1/2 doivent être activées en quantités suffisantes pour avoir ses effets bénéfiques dans l’organisme.
Identité des protéines ERK1/2 dans différentes banques de données[10]
Protein: ERK-1: Rattus norvegicus: P21708
Human: P27361
ERK-2: Rattus norvegicus: NP_446294
Human: NP_002736
Gene: ERK-1: Rattus norvegicus: GeneID: 50689
Human: GeneID: 5595
ERK-2: Rattus norvegicus: GeneID: 116590
Human: GeneID: 5594
OMIM (Human): ERK-1: *601795
ERK-2: *176948
SwissProt (Human): ERK-1: P27361
ERK-2: P28482
Propriétés physico-chimiques
TABLEAU 3: Propriétés physico-chimiques de ERK1/2[11] - [12] - [13]
| Propriétés | ERK-1 | ERK-2 |
|---|---|---|
| Poids moléculaire (kDa) | 43 135,57 | 41 258,51 |
| Point isoélectrique (pI) | 6,28 | 6,53 |
| Charge à pH 7,0 | -1,6 | -0,1 |
| Indice d’instabilité | 67,32 | 72,47 |
| Hydropathie (GRAVY) | -0,232 | -0,380 |
| Pourcentage des hélices alpha (%) sur la totalité de la structure secondaire | 33,8 | 34,4 |
| Pourcentage des feuillets bêta (%) sur la totalité de la structure secondaire | 13,5 | 15,3 |
| Pourcentage des boucles (%) sur la totalité de la structure secondaire | 52,8 | 50,3 |
Notes et références
- Phosphosite, http://www.phosphosite.org
- Kinexus, http://www.kinexus.ca
- COOPER, M. Geoffrey. La cellule : une approche moléculaire, Bruxelles, DeBoeck Université, 1999c, 674 p.
- ARCAND, Mathieu, et al. #19 : LA PHOSPHORYLATION DE LA SERINE 273 EST REQUISE POUR L’ENTRÉE AU NOYAU DE LA MAP KINASE ERK1, http://www.ircm.qc.ca/uploads/documents/nouvelles/brochure16-05-2003.doc
- MELOCHE Sylvain, Jacques Pouysségur. «The ERK1/2 mitogen-activated protein kinase pathway as a master regulator of the G1- to S-phase transition», Oncogene, Nature Publishing Group, 2007, 3227-3239
- KARP, Gerald. Cell and Molecular biology: concepts and experiments, 3e éd., New York, 2002, 785 p.
- SALINAS, Sara, et al. «SUMOylation regulates nucleo-cytoplasmic shuttling of Elk-1», vol. 165, no 6 (21 juin 2004) The Journal of Cell Biology, 767–773, http://www.jcb.org/cgi/doi/10.1083/jcb.200310136
- ROUX, Philippe, et al. Phosphorylation of p90 Ribosomal S6 Kinase (RSK) Regulates Extracellular Signal-Regulated Kinase Docking and RSK Activity, Vol.23, no 14 (21 avril 2003) Molecular and Cellular Biology, 4796–4804
- BIENVENÜE, Alain. Les Gap et leur action, http://www.biochimie.univmontp2.fr/prot_prot/ras/htmlras/les_gap_et_leur_action.htm
- National Center for Biotechnology Information, https://www.ncbi.nlm.nih.gov/
- Serveur de prédiction de structures secondaires SABLE, http://sable.cchmc.org/
- Site Protein Calculator, http://www.scripps.edu/~cdputnam/protcalc.html
- Site ProtParam, http://ca.expasy.org/tools/protparam.html