Disulfure de glutathion
Le disulfure de glutathion (GSSG) est un dimère de molécules de glutathion unies par un pont disulfure[2].
| Disulfure de glutathion | |
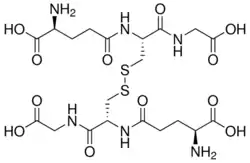 Structure du disulfure de glutathion |
|
| Identification | |
|---|---|
| Nom UICPA | (2S,2’S)-5,5’-[disulfanediylbis({(2R)- 3-[(carboxyméthyl)amino]-3-oxopropane-1,2-diyl}imino)]bis(acide 2-amino-5-oxopentanoïque) |
| Synonymes |
GSSG, glutathion oxydé |
| No CAS | |
| No ECHA | 100.043.777 |
| No CE | 248-170-7 |
| PubChem | 65359 |
| ChEBI | 17858 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C20H32N6O12S2 [Isomères] |
| Masse molaire[1] | 612,631 ± 0,033 g/mol C 39,21 %, H 5,26 %, N 13,72 %, O 31,34 %, S 10,47 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Dans les cellules vivantes, le disulfure de glutathion est réduit en deux molécules de glutathion à l'aide du NADPH, coenzyme réductrice de la glutathion réductase[3]. Des enzymes à l'action antioxydante telles que la glutathion peroxydase et les peroxyrédoxines produisent du disulfure de glutathion en réduisant les peroxydes tels que le peroxyde d'hydrogène H2O2 et les hydroperoxydes organiques[4] :
D'autres enzymes, telles que les glutarédoxines, produisent du disulfure de glutathion par échange thiol-disulfure avec des ponts disulfures de protéines ou d'autres composés à plus faible poids moléculaire tels que le disulfure de coenzyme A et l'acide déshydroascorbique[5] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A. Meister et M. E. Anderson, « Glutathione », Annual Review of Biochemistry, vol. 52, , p. 711-760 (PMID 6137189, DOI 10.1146/annurev.bi.52.070183.003431, lire en ligne)
- (en) S. M. Deneke et B. L. Fanburg, « Regulation of cellular glutathione », American Journal of Physiology, vol. 257, no 4 Pt 1, , L163-L173 (PMID 2572174, lire en ligne)
- (en) Alton Meister, « Glutathione metabolism and its selective modification », Journal of Biological Chemistry, vol. 263, no 33, , p. 17205-17208 (PMID 3053703, lire en ligne)
- (en) A. Holmgren, C. Johansson, C. Berndt, M.E. Lönn, C. Hudemann et C. H. Lillig, « Thiol redox control via thioredoxin and glutaredoxin systems », Biochemical Society Transactions, vol. 33, no Pt 6, , p. 1375-1377 (PMID 16246122, DOI 10.1042/BST20051375, www.researchgate.net/publication/7520814_Thiol_redox_control_via_thioredoxin_and_glutaredoxin_systems/file/d912f50d179d273819.pdf)