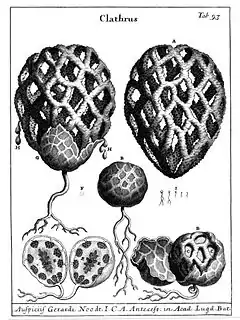
Champignon gastéroïde
Gastéromycètes
l'appellation « Gastéromycète » s'applique en français à plusieurs taxons distincts.

Taxons concernés
Les champignons gastéroïdes (du grec ancien gastêr, « ventre, estomac »), encore souvent appelés gastéromycètes, sont des champignons basidiomycètes chez qui le tissu fertile est interne à l'état jeune. Les spores permettant la reproduction sont ainsi sequestrées dans un réceptacle qui se déchire à maturité et permet la dissémination par le vent, la pluie ou les animaux. Ce réceptacle peut rester globuleux, comme chez les vesses-de-loup ou prendre des formes plus extravagantes, comme chez les satyres.
Le terme « gastéromycète » tire son origine d'une classe créée par Elias Fries en 1821, les Gasteromycetes. L'ensemble réunissant ces champignons prend ensuite divers noms et rangs taxinomiques en fonction des classifications, mais reste considéré comme un taxon unique jusqu'à la fin du XXe siècle, lorsque les données moléculaires en confirment la paraphylie. Il s'avère en effet que le mécanisme passif de sporulation est partagé par de nombreuses espèces qui ne sont pas apparentées entre elles. Les formes gastéroïdes auraient ainsi évolué à plusieurs reprises au sein de clades déjà différenciés et montreraient une adaptation à la dispersion par les animaux et aux climats arides.
Description
.png.webp)
Les champignons gastéroïdes montrent une grande variété de formes et n'ont en commun que leur mécanisme de sporulation. Le tissu fertile, appelé gleba, est situé à l'intérieur de la fructification et protégée par une enveloppe (péridium). À la rupture de la baside, les spores y demeurent en amas poudreux ou gélatineux, alors qu'elles sont ejectées de force chez les autres basidiomycètes[1].
Chez les vesses-de-loup, les bovistes et les sclérodermes, le réceptacle a la forme d'un sac ou d'un pilon. Le péridium se défait complétement et découvre une masse homogène que le vent disperse, ou se déchire seulement au sommet pour créer un orifice (ostiole) par lequel les spores sont éjectées sous la pression des gouttes de pluie. Pour les géastres, la membrane externe s'ouvre en étoile et laisse apparaître un sac semblable à celui des vesses-de-loup, d'où les spores sont ensuite libérées de façon analogue[2].
Chez les phalles ou satyres, la gleba visqueuse est exposée au sommet d'une tige après la rupture de la volve. Ces champignons dégagent de plus une odeur nauséabonde qui attire les insectes chargés de la dissémination des spores. Pour les clathres, ce réceptacle prend la forme d'une étoile à plusieurs bras ou d'une cage (par anostomose des bras)[1]. Chez les cyathes et les crucibules, les spores sont produites à l'intérieur de péridioles contenus dans une coupe qui leur donne l'aspect d'un nid d'oiseau, et qui est initialement recouverte par une membrane fragile. Ces « œufs » sont éjectés de leurs « nids » par la pluie. Ils sont munis d'un petit crochet qui leur permet de rester suspendus aux structures végétales environnantes et libèrent les spores lorsque leurs parois se décomposent[2].
Il existe aussi de nombreuses formes hypogées, c'est-à-dire qui se développent enfouies dans le sol. Elles sont couramment appelées « fausses truffes ». Enfin, les formes dites « sécotioïdes » se présentent comme des champignons à lames ou des bolets « incomplets » : le chapeau ne se déroule pas à maturité, l'hyménium reste séquestré, et il n'y a pas de mécanisme actif de décharge des spores.
Clé simplifiée des principaux groupes
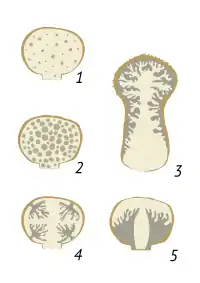
1. uniforme (Tulostoma, Battarrea)
2. lacunaire (Scleroderma, Nidularia)
3. coralloïde (Lycoperdon, Geastrum)
4. multipiléée (Clathrus)
5. unipiléée (Phallus)
Cette clé présente les caractères morphologiques permettant d'identifier les principaux groupes de champignons gastéroïdes. Elle exclut les formes sécotioïdes[3].
- Champignon à hyménium interne
- champignons globuleux enfouis dans le sol → Fausses truffes
- champignons qui poussent à l'air libre
- gléba mucilagineuse à odeur fétide
- gléba à l'extrémité non divisée d'un long pseudostipe → Satyres
- gléba portée par des « bras » ou par un « grillage » → Clathres
- gléba pulvérulente ou compacte à maturité
- stipe bien individualisé d'une tête fertile → Tulostomes
- stipe pas individualisé
- gléba divisée, contenue dans un ou plusieurs péridioles
- unique péridiole mou éjecté par retournement → Sphéroboles
- péridioles durs exposés après déchirement → Nids d'oiseau
- gléba dans un réceptacle unique
- exopéridium qui s'ouvre en étoile → Géastres
- pas d'ouverture en étoile
- gléba immature colorée → Sclérodermes
- gléba immature blanche → Vesses-de-loup
- gléba divisée, contenue dans un ou plusieurs péridioles
- gléba mucilagineuse à odeur fétide
Histoire taxinomique
Des origines au système friesien
Christiaan Hendrik Persoon est le premier à avoir proposé une classification des champignons supérieurs basée sur la maturation des spores. Dans son Synopsis methodica fungorum publié en 1801, il sépare ainsi les Angiocarpi (angeion « pot » ou « récipient »), chez qui cette maturation se déroule à l'intérieur d'un réceptacle, des Gymnocarpi (gymno « nu »), où le processus a lieu à l'extérieur. Elias Magnus Fries adopte dans les grandes lignes le système mis au point par Persoon et crée les classes des Hymenomycetes et des Gasteromycetes, qui se distinguent par la présence (chez les premiers) ou l'absence (chez les seconds) d'un hyménium exposé. Par la suite et durant tout le XIXe siècle, la conception dominante des gastéromycètes est celle d'un groupe basal de champignons, caractérisé par un tissu fertile interne et un mécanisme passif, jugé comme primitif, de libération des spores. Ces mêmes considérations conduisent ensuite à séparer les gastéromycètes en deux sous-groupes : les Exogastrinae (ou Exogasteromycetidae, ou encore Hymenophorinae), qui comprennent notamment les satyres, forment un hyménium vrai, alors que les basides sont isolées chez les Endogastrinae (ou Endogasteromycetidae, ou encore Plectohymenineae), comme les vesses-de-loup[4].
Les débats du XXe siècle
Dans la plupart des classifications du XXe siècle, les gastéromycètes continuent d'être considérés comme un taxon unique, même si l'accumulation des données morphologiques, biochimiques et génetiques rendent les frontières du groupe de plus en plus floues. En 1902, Fedor Bucholtz découvre ainsi de nombreux points communs avec les champignons à lames et suggère que ces derniers pourraient avoir évolué à partir d'ancêtres gastéroïdes, ou le contraire [5]. Le débat entre « gastéromycètes précoces » et « gastéromycètes tardifs » anime ensuite les mycologues pendant près d'un siècle. On découvre en effet des affinités troublantes entre des champignons dont la morphologie générale semble très éloignée : par exemple, les « fausses truffes » du genre Zelleromyces ont des spores amyloïdes et ornementées, et produisent du latex, ce qui les rapprochent étrangement des lactaires[6]. Harry D. Thiers (en) est l'un des premiers à avancer, en 1984, que la morphologie gastéroïde ne peut être que dérivée, car l'hypothèse inverse signifierait que le mécanisme actif de largage des spores aurait été développé plusieurs fois au cours de l'évolution (principe de parcimonie)[7]. Vers la fin du siècle, on note une tendance à considérer les hypothèses phylogénétiques comme dépassant le domaine de l'évaluation objective[6]. La classification friesienne, bien qu'on la sache inexacte, continue donc de séduire par sa simplicité. Ainsi, la quatrième édition de 1996 de Introductory Mycology, l'un des manuels majeurs de la discipline, présente toujours les Gastéromycètes de manière groupée, tout en admettant qu'il ne s'agit pas d'un taxon monophylétique[8].
Les apports de la phylogénie moléculaire
Les premières études moléculaires en mycologie s'attachent justement à démêler la phylogénie du groupe. En 1989, une comparaison des ADN mitochodriaux démontrent par exemple que la fausse-truffe Rhizopogon a évolué à partir d'un ancêtre bolétoïde proche du genre Suillus[9]. En 1994, les genres sécotioïdes Podaxis et Montagnea sont rapprochés des coprins[10], et la fausse-truffe Hydnangium des laccaires[11]. Mais c'est la première étude multi-locus portant sur les relations phylogénétiques de niveau supérieur des Homobasidiomycetes qui démantèle en 1997 le cœur des Gastéromycètes. En analysant les séquences nucléotidiques de gènes codant l'ARN ribosomal de 81 espèces, elle découvre en effet quatre origines distinctes pour les formes gastéroïdes les plus étudiées. Deux clades homogènes et bien différenciés sont ainsi nichés au milieu des « Agarics vrais ». Le premier unit les vesses-de-loup et les tulostomes (Lycoperdon, Calvatia et Tulostoma), à proximité des agarics, lépiotes et coprins, et le second représente les nids d'oiseau (Cyathus et Crucibulus). Les sclerodermes (Scleroderma) forment quant à eux un groupe frère des bolets. Enfin, un quatrième clade réunit les satyres, les géastres et les sphéroboles (Pseudocolus, Geastrum et Sphaerobolus), que les classifications précédentes plaçaient dans trois ordres distincts. Ces derniers consituent un groupe frère avec des formes gomphoïdes et clavarioïdes (Gomphus, Ramaria)[12]. Ces bouleversements sont, parmi d'autres, inclus dans la neuvième édition du Dictionary of the Fungi de 2001, qui découpe les Agaricomycetes en 8 ordres et entérine la disparition des Gastéromycètes comme goupement taxinomique.
Classification actuelle
De nombreux clades de champignons agaricomycètes ont développé des formes gastéroïdes et ces dernières, loin de constituer un groupe homogène, sont réparties dans chacun des principaux ordres de la classe. Parmi les familles les plus connues de l'ancienne classe des Gasteromycetes, les Lycoperdaceae (vesses-de-loups) et les Nidulariaceae (nids d'oiseaux) ont été attribuées à l'ordre des Agaricales, et les Sclerodermataceae (sclerodermes) et les géastres du genre Astraeus à celui de Boletales. Les Phallaceae et les Geastraceae constituent leurs propres ordres, qui ont été rapprochés des Gomphales pour former une sous-classe bien différenciée : les Phallomycetidae. Cette dernière comprend en outre de nombreux autres formes non-gastéroides[13].
| Sous-classes | Ordres | Formes épigées | Formes hypogées | ||
|---|---|---|---|---|---|
| Agaricomycetidae | Agaricales | .jpg.webp) |
 |
 | |
| Boletales |  |
 |
 | ||
| - | Russulales |  |
 |
 | |
| Phallomycetidae | Phallales |  |
 |
 | |
| Geastrales | _(15855448222).jpg.webp) |
 |
 | ||
| Hysterangiales | Aucune |  | |||
| Gomphales | Aucune |  | |||
Histoire évolutive
Les champignons gastéroïdes représentent environ 8,4% des taxons de la classe des Agaricomycetes. Plusieurs lignées ont évolué vers cette forme à partir d'ancêtres qui produisaient leurs spores sur leurs surfaces externes, comme les champignons à lames, les polypores ou les clavaires. Ces derniers ont un mécanisme complexe de décharge forcée des spores qui est perdu chez les lignées gastéroïdes, ce qui rend l'évolution inverse très improbable. La « gastéromycétation » serait une adaptation à la dispersion par les animaux et aux climats arides[15].
Chez les Agaricales, les formes gastéroïdes se sont développées à de multiples reprises et on évolué aussi bien à partir des groupes mycorhiziens que des groupes saprotrophes[6].
- Évolution des formes au sein de la famille des Cortinariaceae
 Cortinarius vanduzerensis - forme agaricoïde épigée
Cortinarius vanduzerensis - forme agaricoïde épigée Cortinarius verrucisporus - forme « émergente », à voile persistant
Cortinarius verrucisporus - forme « émergente », à voile persistant.jpg.webp) Thaxterogaster spp. - forme sécotioïde
Thaxterogaster spp. - forme sécotioïde Hymenogaster sublilacinus - forme gastéroïde hypogée
Hymenogaster sublilacinus - forme gastéroïde hypogée
Les Phallales montrent un cas unique de transformation hypogée en épigée : certaines des formes les plus extravagantes de tous les champignons (Phallus, Clathrus) sont en effet nichées dans un assemblage paraphylétique de fausses-truffes (Claustula, etc.) Leurs fructifications très voyantes (en forme de phallus, de cage ou d'étoile) ont souvent des pigments rouge ou jaune vifs et présentent une gleba très aromatique. Elles se sont apparemment diversifiées en réponse à la sélection pour la dispersion des spores par les insectes et représentent en quelque sorte les « fleurs » des champignons[6].
Références
- J. Walton Groves, Champignons comestibles et veneneux du canada., Approvisionnements et Services Canada, , 336 p. (ISBN 0-660-90741-0 et 978-0-660-90741-3, OCLC 299370976, lire en ligne).
- Jean Després (dir.), L'univers des champignons, Les Presses de l'Université de Montréal, , 377 p. (ISBN 978-2-7606-2794-9 et 2-7606-2794-2, OCLC 892341082, lire en ligne), chap. 1 (« L'anatomie et la diversité des formes »).
- Serge Poumarat, Clé des gastéromycètes épigés d'Europe, , 89 p. (lire en ligne [PDF]).
- (en) A.F.M. Reijnders, « A morphogenetic analysis of the basic characters of the gasteromycetes and their relation to other basidiomycetes », Mycological Research, vol. 104, no 8, , p. 900–910 (DOI 10.1017/S0953756299002233, lire en ligne, consulté le ).
- (ru) Yuri Rebriev, « Гастеромицеты. Современные взгляды на объем группы и положение в системе Basidiomycetes » [« The Gasteromycetes. Modern views on the boundaries of the group and its position in the system of Basidiomycetes »], Mikologiya I Fitopatologiya, vol. 39, , p. 3-10 (lire en ligne).
- (en) David S. Hibbett, « After the gold rush, or before the flood? Evolutionary morphology of mushroom-forming fungi (Agaricomycetes) in the early 21st century », Mycological Research, vol. 111, no 9, , p. 1001–1018 (DOI 10.1016/j.mycres.2007.01.012, lire en ligne, consulté le ).
- (en) Harry D. Thiers, « The Secotioid Syndrome », Mycologia, vol. 76, no 1, , p. 1 (DOI 10.2307/3792830, lire en ligne, consulté le ).
- (en) Constantine John Alexopoulos, Charles W. Mims et Meredith M. Blackwell, Introductory mycology, Wiley, , 4e éd., 880 p. (ISBN 0-471-52229-5 et 978-0-471-52229-4, OCLC 33012821, lire en ligne).
- (en) Thomas D. Bruns, Robert Fogel, Thomas J. White et Jeffrey D. Palmer, « Accelerated evolution of a false-truffle from a mushroom ancestor », Nature, vol. 339, no 6220, , p. 140–142 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/339140a0, lire en ligne, consulté le ).
- (en) John S. Hopple et Rytas Vilgalys, « Phylogenetic Relationships among Coprinoid Taxa and Allies Based on Data from Restriction Site Mapping of Nuclear rDNA », Mycologia, vol. 86, no 1, , p. 96 (DOI 10.2307/3760723, lire en ligne, consulté le ).
- (en) Gregory M. Mueller et Elizabeth M. Pine, « DNA data provide evidence on the evolutionary relationships between mushrooms and false truffles », McIlvainea, vol. 11, , p. 61-74 (lire en ligne).
- (en) David S. Hibbett, Elizabeth M. Pine, Ewald Langer, Gitta Langer et Michael J. Donoghue, « Evolution of gilled mushrooms and puffballs inferred from ribosomal DNA sequences », Proceedings of the National Academy of Sciences, vol. 94, no 22, , p. 12002–12006 (ISSN 0027-8424 et 1091-6490, PMID 9342352, PMCID PMC23683, DOI 10.1073/pnas.94.22.12002, lire en ligne, consulté le ).
- (en) David S. Hibbett, R. Bauer, M. Binder, Admir J. Giachini et al., chap. 14 « Agaricomycetes », dans The Mycota : Systematics and Evolution, vol. 7A, Springer Berlin Heidelberg, , 373–429 p. (ISBN 978-3-642-55317-2, DOI 10.1007/978-3-642-55318-9_14, lire en ligne).
- (en) Kentaro Hosaka, Scott T. Bates, Ross E. Beever, Michael A. Castellano et al., « Molecular phylogenetics of the gomphoid-phalloid fungi with an establishment of the new subclass Phallomycetidae and two new orders », Mycologia, vol. 98, no 6, , p. 949–959 (ISSN 0027-5514 et 1557-2536, DOI 10.1080/15572536.2006.11832624, lire en ligne, consulté le ).
- (en) Andrew W. Wilson, Manfred Binder et David S. Hibbett, « Effects of gasteroid fruiting body morphology on diversification rates in three independent clades of fungi estimated using binary state speciation and extinction analysis », Evolution, vol. 65, no 5, , p. 1305–1322 (DOI 10.1111/j.1558-5646.2010.01214.x, lire en ligne, consulté le ).