Cambium
Le cambium (du latin cambiare, changer), appelé « seconde écorce » ou « écorce intérieure », est une fine couche de cellules méristématiques secondaires qui sont des cellules indifférenciées pouvant toutes se diviser[3] - [4]. Ce tissu méristématique est situé entre le bois (ou xylème secondaire) et le liber (ou phloème secondaire). Le cambium est le tissu qui est responsable de la formation du bois (« croissance radiale »), saisonnière en climat froid et tempéré, et plus régulière en zone équatoriale. Son activité présente une certaine plasticité : en modifiant en permanence les propriétés du bois qu'il forme, il permet à l'arbre durant sa vie de s’adapter à la plupart des contraintes et variations de son environnement immédiat, y compris aux contraintes mécaniques et hydrauliques liées à sa croissance et à son poids[5] - [6].
Il est bien connu dans le tronc, mais il est aussi présent dans les tiges et les racines des dicotylédones pluriannuelles et des gymnospermes ; c'est un méristème secondaire (assurant la croissance en diamètre) de ces plantes.
Il se forme lui-même à partir du procambium, couche unicellulaire.

En greffage, la réussite de la greffe dépend de la bonne mise en contact des cambiums du porte-greffe et du greffon.
Chez les plantes non aquatiques on peut distinguer deux types de cambium :
- Cambium vasculaire bifacial, solution évolutive qui a donné à l'arbre de larges possibilités d'adaptation (plasticité phénotypique)[7] ;
- Cambium vasculaire monofacial, primitif et ne produisant que du xylème[8] ; apparu au Dévonien inférieur selon les fossiles disponibles (-400 millions d’années environ)[9] et encore présent chez les fougères arborescentes (permettant moins d'adaptation de forme).
Histoire de la connaissance du cambium
C'est le botaniste anglais Nehemiah Grew qui utilisa ce terme de médecine pour nommer cette zone en 1672 dans The anatomy of vegetables. Il désignait cette région extérieure au bois comme étant l’endroit où l’humeur nutritive fermentait puis se « changeait » en bois, d’où ce nom (du latin classique cambire : changer).
En 1758, Henri-Louis Duhamel du Monceau précise le rôle de cette fine couche dans La Physique des arbres (traitant de physiologie végétale)[10]. Il y explique que si l'on insère au moyen d'une aiguille des fils d'argent entre le bois et l’écorce d'arbres, s'ils sont insérés sous le cambium, on les retrouvera noyés dans le bois, alors que s'ils sont insérés entre le cambium et l'écorce, ils y resteront, ce qui montre que le cambium ne produit pas que le bois. Duhamel ne comprend cependant pas comment cette couche qu'il prend à tort pour un mucilage produit à la fois du bois et du tissu cortical (base de l'écorce).
En , Kurt Sprengel le décrit comme étant un Bildungssaft (une sève formatrice)[11] puis en de Mirbel n'y voit plus un fluide, mais une « couche régénératrice »[12].
C'est au cours des années 1850-1858 que les botanistes admirent l'existence d'une zone génératrice « cellulaire » donnant naissance au xylème et au phloème, ces deux termes étant créés par Karl Wilhelm von Nägeli en 1858 dans Breitraege zur wisseschaftliche Botanik[13].
Le choix de « cambium » pour désigner cette zone prête à confusion car il n'y a aucun changement ; le terme « xylogène » serait plus approprié et serait le pendant de « phellogène » l'autre méristème secondaire des dicotylédones arbustives et des gymnospermes.
Cambium et méristèmes secondaires
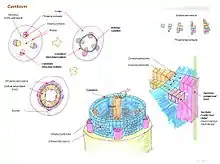
On distingue deux types de méristèmes secondaires[14] :
- la zone génératrice libéroligneuse, cambium vasculaire (terme anglo-saxon), assise libéro-ligneuse (ALL) ou cambium libéro-ligneux, qui met en place les vaisseaux conducteurs secondaires. C'est la plupart du temps une couche cylindrique mince qui différencie, au sein de la racine et de la tige :
- vers l'intérieur : le bois (ou xylème II). Les nouvelles cellules créées se différencieront en grandes cellules lignifiées de xylème secondaire ou bois,
- vers l'extérieur : le liber (ou phloème II). Les nouvelles cellules créées deviendront des cellules de phloème secondaire ou liber de petites dimensions, vivantes, mais sans noyau et sans épaississements de lignine[alpha 1] ;
- L'activité de cette assise de cellules cesse en hiver et reprend au printemps.
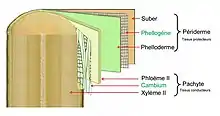
- la zone génératrice subéro-phellodermique ou phellogène ou assise subéro-phellodermique (ASP), située vers la périphérie de la tige ou de la racine, qui met en place les tissus externes :
- le phelloderme vers le centre de la tige, pas toujours présent,
- le liège vers l'extérieur.
Suivant le genre et même l'espèce, l'activité du phellogène est très variable. Souvent son activité cesse, une nouvelle assise s'initie au sein du phloème secondaire. Ce processus pluriannuel conduit à la formation de structures présentant une relative complexité. Le phellogène le plus interne détermine la limite au-delà de laquelle tous les tissus périphériques, constitués de cellules mortes, forment le rhytidome. Sous le phelloderme le plus récent, se trouve l'écorce interne (liber au sens strict) constituée de cellules vivantes.
Notons que le terme cambium, en français, est réservé à la seule zone génératrice libéroligneuse.
L'anneau cambial

La zone génératrice libéroligneuse n'étant composée que d'une seule assise de cellules, elle se présente de façon sinueuse puis, à mesure de l'accroissement du diamètre, sous la forme d'un cylindre[15] appelé parfois « anneau cambial ».
- Un cambium se crée à partir des cellules de parenchyme interfasciculaire[alpha 2] qui subissent une dédifférenciation[16]. Un anneau complet est issu de la fusion de deux types de zones cellulaires : les cellules de cambium interfasciculaire[alpha 2] et les cellules du cambium intrafasciculaire[alpha 3]. Cette fusion forme ainsi l'anneau cambial.
Chez certaines plantes, notamment les plantes ligneuses dicotylédones, un anneau cambial se forme dès que la croissance en longueur cesse, parfois après une dizaine de jours, la structure secondaire débute, le phellogène s'initiera plus tard.
L'accroissement en diamètre peut provoquer des inclusions. Voir l'image ci-contre.
Chez d'autres plantes, en particulier les monocotylédones, on ne retrouve du cambium qu'à l'intérieur des faisceaux vasculaires[17], entre le xylème primaire et le phloème primaire.
Ce cambium étant discontinu, on ne parle alors plus d'anneau cambial.
- Chez les monocotylédones, l'absence de cambium et son corollaire, l'absence de formations secondaires rend mécaniquement difficile la ramification de l'appareil végétatif[18].
Notons que le terme cambium, en français, est réservé à la seule zone génératrice libéroligneuse.
Alimentation humaine

Le liber, appelé aussi phloème secondaire ou écorce interne de certains arbres, a été consommé par des humains comme aliment. Il faut éviter de prélever le cambium tout autour d’un arbre car cela le tuerait[19].
Le liber des arbres suivants est comestible, et a été consommé[19] : saule (Salix alba), hêtre (Fagus sylvatica, Fagus orientalis), érable (tous), bouleau (Betula pendula[20]), tilleul (tous), orme (Ulmus glabra, Ulmus minor/campestris, Ulmus fulva), peuplier (Populus alba, Populus nigra, Populus tremula), frêne de Pennsylvanie[20], et Pinaceae (tous). Plus précisément :
- dans les pays nordiques, le liber de saule, de bouleau et de hêtre était mélangé à de la farine de céréales ;
- en Norvège et en Chine, le liber d'orme était mélangé à de la farine ; il était également donné aux bébés et aux malades ;
- en Scandinavie, le liber de hêtre et de bouleau était mélangé à de la farine ;
- en Laponie et en Sibérie, le liber de bouleau a été consommé ; le cambium de Larix decidua était chez les Yakoutes sibériens consommé dans un bouillon de lait, de farine et de poisson[21]
- en Europe, le liber des peupliers et de Pinus sylvestris a été consommé mélangé à de la farine ; plus largement, le liber de la famille des Pinaceae était découpé en lanières et cuit comme des pâtes ;
- le liber de Pinus contorta a été consommé par les amérindiens ;
- en Asie, le liber de peuplier a été consommé ;
- le tronc du sagoutier est l'alimentation de base des Korowai[22] et des Punan, qui sont des peuples chasseurs cueilleurs.
Le cambium (réserve de cellules-souches) et le phellogène peuvent se régénérer si la blessure n'est pas trop étendue. Chez le peuplier la nouvelle écorce se forme en un mois[23].
Pour l'utilisation du liber sous forme de pain :
Recherche
Les mécanismes biologiques et abiotiques qui régulant la formation du bois et la taille, forme et disposition des nouvelles cellules, en lien avec le modèle architectural propre à l'essence sont encore peu connus. « On ne sait pas précisément à travers quels intermédiaires les conditions environnementales influencent la quantité et les propriétés du bois formé. »[24] On ignore aussi si le cambium dispose de biocapteurs et de mécanismes intrinsèques de régulation de la production du bois, ou si cette régulation est le fait de phytohormones ou d'autres signaux encore à explorer[25]. En 2015, la thèse de Félix Hartmann a proposé un modèle biophysique du cambium et de son fonctionnement.

Notes et références
Notes
- Le terme « secondaire » différencie ces nouveaux tissus du xylème et phloème primaires.
- Cellules interfasciculaires : cellules situées entre les faisceaux vasculaires.
- Cellules intrafasciculaires : cellules situées à l'intérieur des faisceaux vasculaires.
Références
- (en) Reader's Digest, Our Amazing World of Nature, Reader's Digest Association, , p. 119
- (en) Roy Genders, A History of Scent, Hamilton, , p. 186
- Allsopp, A. (1964). Shoot Morphogenesis. Annual Review of Plant Physiology, 15(1):225–254.
- Elo, A., Immanen, J., Nieminen, K. et Helariutta, Y. (2009). Stem cell function during plant vascular development. Semin. Cell Dev. Biol., 20(9):1097–106.
- Day M.E et Greenwood M.S (2011) Regulation of Ontogeny in Temperate Conifers. In Meinzer, F. C., Lachenbruch, B. et Dawson, T. E., éditeurs : Size- and Age-Related Changes in Tree Structure and Function, volume 4 de Tree Physiol., pages 91–119. Springer Netherlands
- Agusti J et Greb T (2013) Going with the wind–adaptive dynamics of plant secondary meristems. Mech. Dev., 130(1):34–44. Cité pages 14 et 20.
- Rowe N et Speck T (2005). Plant growth forms: an ecological and evolutionary perspective. New Phytologist, 166(1):61–72.
- DiMichele W.A, Elrick S.D & Bateman R.M (2013) Growth habit of the late Paleozoic rhizomorphic tree-lycopsid family Diaphorodendraceae: Phylogenetic, evolutionary, and paleoecological significance. American Journal of Botany, 100(8):1604–1625.
- secondaires par opposition aux méristèmes primaires uniquement situés aux extrémités de rameaux et de racines. Hoffman L.A & Tomescu A.M.F (2013) An early origin of secondary growth: Franhueberia gerriennei gen. et sp. nov. from the Lower Devonian of Gaspé (Québec, Canada). American Journal of Botany, 100(4):754–763.
- Henri-Louis Duhamel Du Monceau, La physique des arbres, où il est traité de l'anatomie des plantes et de l'économie végétale pour servir d'introduction au traité complet des bois et forests..., Paris, H.-L. Guérin et L.-F. Delatour, (lire en ligne).
- Sprengel C (1812) Von dem Bau und der Natur der Gewächse. Kümmel.
- de Mirbel C-F.B (1816) Note sur le cambium et le liber. Bulletin des Sciences par la Société Philomatique de Paris, pages 107–108.
- Voir Anne-Marie Catesson : "Origine, fonctionnement et variations cytologiques saisonnières du Cambrium de l'Acer pseudoplatanus L", 1964.
- R. Heller, R. Esnault et C. Lance, Physiologie végétale, t. 2.Développement, Paris, Dunod, , 6e éd., 366 p. (ISBN 2-10-004497-4), p. 4.
- Prost P.-J., La botanique ses applications agricoles, t. I Morphologie, anatomie, physiologie de la reproduction, Paris, Baillière et Fils, , 1re éd., 328 p., p. 162
- Alain Routeaud, « LesAngiospermes », (consulté le ) : « Ce cambium s’individualise à partir de cellules parenchymateuses de tige, déjà relativement différenciées. Ces cellules subissent donc une dédifférenciation », p. 35
- Lüttge U., Kluge M. et Bauer G. (trad. de l'allemand), Botanique : traité fondamental, Paris, Tec et Doc, , 3e éd., 588 p. (ISBN 2-7430-0141-0), p. 376
- Aymonin G.-G., Guignard J.-L. et Baillet A., Pourquoi les Monocotylédones ? Une introduction pour une clé, vol. 151 (Acta botanica gallica), t. 2, Châtenay-Malabry (France), Société botanique de France, , 8 p. (ISSN 1253-8078, lire en ligne), p. 139-146
- François Couplan, Le régal végétal : plantes sauvages comestibles, Paris, Editions Ellebore, , 527 p. (ISBN 978-2-86985-184-9, lire en ligne).
- François Couplan, Cuisine sauvage : accommoder mille plantes oubliées, Paris, Editions Sang de la terre, , 637 p. (ISBN 978-2-86985-245-7, lire en ligne)
- Couplan, François (2009) Le régal végétal : plantes sauvages comestibles ; Editions Ellebore, 527 pages
- (fr) [vidéo] sur YouTube
- (en) Jia-Jia Chen, Jing Zhang et Xin-Qiang He, « Tissue regeneration after bark girdling: an ideal research tool to investigate plant vascular development and regeneration », Physiologia Plantarum, vol. 151, no 2, , p. 147–155 (ISSN 1399-3054, PMID 24111607, DOI 10.1111/ppl.12112, lire en ligne, consulté le )
- Félix H (2015) Modélisation biophysique de l’activité cambiale et de la formation du bois Thèse de Doctorat en Biologie végétale et forestière ; AgroParisTech & Laboratoire d’Étude des Ressources Forêt-Bois (LERFoB), soutenue le 18 juin.
- Cuny H.E, Rathgeber C.B.K, Kiesse T.S, Hartmann F.P, Barbeito I & Fournier M (2013) Generalized additive models reveal the intrinsic complexity of wood formation dynamics. J. Exp. Bot., 64(7):1983–1994.
Voir aussi
Articles connexes
Bibliographie
- Félix H (2015) Modélisation biophysique de l’activité cambiale et de la formation du bois Thèse de Doctorat en Biologie végétale et forestière ; AgroParisTech & Laboratoire d’Étude des Ressources Forêt-Bois (LERFoB), soutenue le 18 juin.
