Bromure de gallium(III)
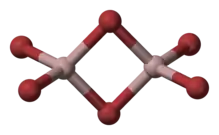
Le bromure de gallium(III) est un composé chimique de formule GaBr3. Il s'agit d'un solide blanc inodore très hygroscopique qui dégage une fumée abondante dans l'air humide. Il est soluble dans l'eau en s'hydrolysant[3]. À l'état solide, les molécules s'arrangent en dimères formant des tétraèdres GaBr4 ayant des arêtes communes, cristallisant dans le système monoclinique selon le groupe d'espace P21/c (no 14) avec les paramètres a = 887,4 pm, b = 563,7 pm, c = 1 100,6 pm et β = 107,81°[4].
| Bromure de gallium(III) | |||
| |||
| Dimère de bromure de gallium(III) | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | tribromogallane | ||
| Nom systématique | bromure de gallium(III) | ||
| Synonymes |
tribromure de gallium |
||
| No CAS | |||
| No ECHA | 100.033.267 | ||
| No CE | 236-609-5 | ||
| PubChem | 83477 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc[1] | ||
| Propriétés chimiques | |||
| Formule | Br3Ga |
||
| Masse molaire[2] | 309,435 ± 0,004 g/mol Br 77,47 %, Ga 22,53 %, |
||
| Propriétés physiques | |||
| T° fusion | 121 °C[1] | ||
| T° ébullition | 278 °C[1] | ||
| Masse volumique | 3,69 g/cm3[1] | ||
| Précautions | |||
| SGH[1] | |||
 Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le bromure de gallium(III) peut être obtenu en faisant réagir du gallium métallique ou de l'oxyde de gallium(III) Ga2O3 avec du bromure d'hydrogène HBr :
Il peut également être produit directement à partir des éléments[5] :
Le bromure de gallium(III) peut être utilisé comme catalyseur en synthèse organique, notamment l'alkylation de composés aromatiques par les bromoalcanes[1], avec un mécanisme réactionnel semblable à celui du trichlorure de gallium GaCl3 ; ce dernier composé peut être préféré à GaBr3 en raison de sa plus grande polyvalence[6].
Notes et références
- « Fiche du composé Gallium(III) bromide, ultra dry, 99.998% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart, 1975, p. 853. (ISBN 3-432-02328-6)
- (en) Sergey I. Troyanov , Thoralf Krahl et Erhard Kemnitz, « Crystal structures of GaX3 (X = Cl, Br, I) and AlI3 », Zeitschrift für Kristallographie - Crystalline Materials, vol. 219, no 2, , p. 88-92 (DOI 10.1524/zkri.219.2.88.26320, Bibcode 2004ZK....219...88T, lire en ligne).
- (en) Georg Brauer, Handbook of Preparative Inorganic Chemistry, Elsevier, 2012, p. 995. (ISBN 0-323-16127-8)
- (en) Bruce R. King, Encyclopedia of Inorganic Chemistry, Wiley, 1994, p. 1265-1267. (ISBN 978-0-471-93620-6)

