Bicoïd (gène)
Bicoïd (bcd) est un gène à effet maternel déposé dans l’ovocyte par la femelle lors de l’ovogenèse. Il s’exprime au niveau de l’œuf et intervient dans le développement de l'axe antéro-postérieur chez la drosophile et plus précisément dans la détermination précoce du patron de développement de la région antérieure chez l'embryon. Cette région qui se développe plus tard pour former la tête et la partie thoracique chez l'adulte.
Il s'agit aussi du premier morphogène connu, dont le gradient de concentration décroissant depuis la partie antérieure de l’ovocyte, spécifie différentes régions chez l’embryon et permet la formation de ses axes de polarité[1].
Bicoïd possède aussi une homéoboîte qui code un homéodomaine. Cette séquence est impliquée dans la régulation de l’expression de plusieurs gènes qui se trouvent le long de l’axe antéro-postérieur de la drosophile. La protéine (bcd) agit donc soit comme un facteur de transcription qui stimule la synthèse des ARNm à partir de l'ADN, soit comme un inhibiteur de la traduction des ARNm en protéines, selon les gènes concernés[2].
Origine
Le gène Bicoïd a évolué il y a approximativement 150 million années à partir d’une duplication, une mutation génétique, du gène homéotique Hox3[3].
Les gènes Hox figurent parmi les gènes les mieux conservés au cours de l’évolution, ils sont impliqués dans la spécification de l’identité des segments chez l’embryon, le gène Hox3 a toutefois perdu cette fonction chez les Cyclorrhapha au cours de l’évolution. Il s'est impliqué dans le développement de l’épithélium extra-embryonnaire chez ces diptères. Une duplication suivie d’une divergence de ce gène a donné naissance à deux nouveaux gènes, à savoir un gène zygotique Zerknüllt et un gène à effet maternel Bicoïd impliqués dans l’établissement du tissu extra-embryonnaire sur le côté dorsal du corps et dans la détermination de la partie antérieure chez les embryons des insectes, respectivement.
Contrairement à Zerknüllt, qui est exprimé chez plusieurs espèces d’insectes tel que Empis livida, (famille des Tabanidae), Clogmia albipunctata (famille des Psychodidae), Haematopota pluvialis (famille des Empididae), le gène Bicoïd n’a pas d’homologue chez les autres insectes et ne se trouve que chez les dyptères cyclorrhaphes (les mouches), comme la Drosophila melanogaster, c’est donc un gène homéotique très dérivé[4].
Mise en place de la région antérieure chez la Drosophile par le gène Bicoïd au cours de l'ovogenèse
Ovogénèse chez la Drosophile melanogaster
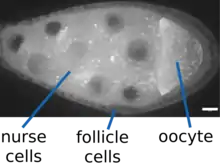
Chez la drosophile, l'asymétrie de l'ovocyte et la formation de l'axe antéro-postérieur se fait sous le contrôle génétique maternel[1]. Lors l'ovogenèse chez la femelle de type sauvage, une cellule souche de lignée germinale, située au niveau d'un germanium, la partie la plus distale de l'ovariole, subit une division asymétrique afin de donner une autre cellule souche ainsi qu'une cellule nommée cystoblaste (une cellule germinale). Le cystoblaste subit par la suite 4 divisions mitotiques à cytocinèse incomplète, ça veut dire que la division cellulaire se fait sans séparation complète du cytoplasme entre les cellules filles. Ces divisions mitotiques produisent alors 16 cellules filles interconnectées entre-elles via des ponts cytoplasmiques, aussi appelés des « rings canals ». Le tout forme un syncytium nommé cyste germinal. L'une de ces 16 cellules filles se différencie en ovocyte et se positionne dans la partie postérieure et les 15 autres cellules deviennent des cellules nourricières situées dans la partie antérieure. Le rôle de ces cellules nourricières est de fournir des protéines et des ARNm pour l'ovocyte afin d'assurer son développement. La structure ainsi obtenue est entouré par un tissu épithélial formé par des cellules somatiques folliculaires. Le tout se détache par la suite du germanium pour former une chambre ovarienne ou follicule[5].
Acheminement de l'ARNm à la partie antérieur de l'ovocyte
Le développement précoce de la partie antérieure de l'ovocyte est alors initié par des signaux provenant du follicule et par les interactions entre cet ovocyte et les cellules folliculaires. Le tout commence par le gène Bicoïd qui est localisé au niveau des cellules nourricières où il est activement transcrit en ARNm Bicoïd. Ces ARNm sont relâchés par la suite dans le cytoplasme et acheminés vers l'ovocyte en passant à travers les ponts cytoplasmiques. En premier lieu, ces ARNm s'accumulent dans la partie postérieure de l'ovocyte (durant les stades 4 à 6) et ils sont par la suite repositionner dans la partie antérieure (aux stades 7 à 8) par l'intermédiaire d'une protéine nommée Gurken. Pour ce faire, l'ovocyte traduit le gène à effet maternel Gurken en ARNm au sein de son noyau. Celui-ci est ensuite relâché dans le cytoplasme à proximité de la partie postérieure de l'ovocyte et est traduit en protéine Gurken. Cette protéine agit sur les cellules folliculaires postérieures en se liant à leur récepteur Torpedo. À la suite de ce signal reçu de la part du ligand Gurken, les cellules folliculaires postérieures émettent à leur tour un signal, encore méconnu de nos jours, qui provoque une réorganisation du cytosquelette au niveau de l'ovocyte. Ainsi, les microtubules vont se réorientés de telle sorte que leur extrémité négative (-) va se diriger vers la partie antérieure de l'ovocyte et l'extrémité positive (+), quant à elle, s'oriente vers la partie postérieure[5]. Un autre produit d'un autre gène à effet maternel qu'est la protéine Staufen (stau) entre en jeu pour acheminer l’ARNm Bicoïd à sa destination finale[6]. En effet, cette protéine (stau) reconnaît une région non spécifique et non traduite 3'UTR de l'ARNm Bicoïd et s'y associe. Le complexe ainsi formé se lie au moteur protéique dynéine et le tout se déplace sur les microtubules vers leurs extrémités négatives (-), c'est-à-dire vers la partie antérieure de l'ovocyte[5] - [6]. Finalement, l'ARNm Bicoïd est ancré antérieurement au cortex cellulaire afin d'empêcher sa diffusion le long de l'ovocyte grâce à deux gènes à effet maternel, à savoir Exuperantia et Swallow[7] - [8]. L'ARNm Bicoïd demeure alors dormant jusqu'à la fécondation. (La protéine Bicoïd n'est pas détectable au niveau de l’ovocyte non fécondée).
Fécondation de l'ovocyte et traduction de l'ARNm
La fécondation de l'ovocyte par les spermatozoïdes, stockés au niveau du spermathèque, déclenche l'activation de la traduction de l'ARNm Bicoïd en protéine (Bcd). Ce processus est d'abord initié par une polyadénylation cytoplasmique de l'extrémité 3' de l'ARNm, c'est-à-dire l'ajout d'une queue Poly-A composée d'une séquence d'approximativement 140 ribonucléotides Adénosine (A) à cet endroit-ci. Cette réaction est catalysée par une polymérase poly-A et se fait sous le contrôle de deux gènes, à savoir Cortex et Grauzone qui déterminent la longueur de la queue poly-(A)[9]. Les ARNm ainsi traduits produisent des protéines Bicoïd qui diffusent le long de l'axe antéro-postérieur de l'ovocyte fécondée en formant un gradient de concentration, avec une forte concentration de la protéine (bcd) dans la partie antérieure et une faible concentration dans la région postérieure. Cette protéine induit la différenciation des cellules, le long de l'axe A/P, dépendamment de sa concentration. Ça veut dire que différentes concentrations de (bcd) vont susciter différentes réponses chez les cellules. Ceci leur fournit alors une information de position et cause, par conséquent, la spécification des différentes régions de l'ovule, on parle alors d'un morphogène[10]. La protéine Bicoïd est aussi impliquée dans la régulation de l'activité des différents gène du développement, c'est donc aussi une homéoprotéine.
Structure de la protéine Bicoïd
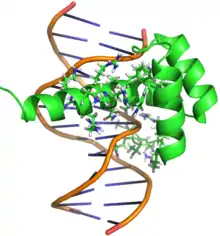
La protéine Bicoïd est composée d'environ 489 acides aminés, c'est la seule homéoprotéine, connue jusqu'à présent, qui est en mesure de se lier et à la molécule d'ADN et à la molécule d'ARN grâce à son homéodomaine. Elle est donc en mesure de réguler la transcription et la traduction, respectivement, des gènes embryonnaires[11].
La protéine Bicoïd agit comme un facteur de transcription; elle comporte deux domaines principaux qui interagissent avec la molécule d'ADN. Un premier domaine situé au niveau de son extrémité N-terminal, situé entre les résidus 1et 246 et incluant l'homéodomaine. Ce domaine permet la liaison de la protéine (bcd) à des régions spécifiques au niveau de la molécule d'ADN. Le second domaine se trouve à l'extrémité carboxy-terminale (C-terminale), compris entre les résidus 247 et 489 et comportant plusieurs régions riches en acides aminés glutamine. Ce domaine est responsable de l'activation de la transcription de l'ADN en ARN[11].
L’homéodomaine est une séquence spécifique d’acides aminés retrouvés chez les homéoprotéines dans la région comprise entre les résidus (92-151)[11]. Cet homéodomaine est composé d'environ 60 acides aminé et il est hautement conservé au cours de l'évolution. Sa structure tridimensionnelle a une forme d’hélice-tour-hélice et consiste en trois hélices α (hélice I, hélice II, hélice III) et lui permet de reconnaître et se lier a des séquences spécifiques au niveau de la molécule d’ADN. L’homéodomaine au niveau de la protéine Bicoïd a aussi la spécificité de se lier aux molécules d’ARN afin de réguler leur traduction en protéines. Pour ce faire, cet homéodomaine comporte un acide aminé lysine à la position 50 qui permet à la protéine de reconnaître les molécules d’ADN et d’ARN. Il comporte aussi un acide aminé arginine à la position 54 qui est exclusivement responsable de la reconnaissance et la liaison à la molécule d’ARN[2].
Cette région riche en arginine au niveau de l’homéodomaine est localisée à l’extrémité C-terminale de l’hélice III. Toute mutation au niveau de cette région altère l’affinité de la protéine Bicoïd pour la molécule d’ARN, mais pas pour la molécule d’ADN. Elle pourra donc reconnaitre et se lier à l’ADN, mais ne sera plus en mesure de faire de même pour l’ARN[12].
Rôle du gène Bicoïd dans la détermination de la région antérieure chez l'embryon de la drosophile
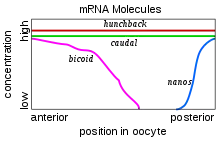
Les différents gènes à effet maternel responsables du développement de l'embryon sont disposés par la mère dans l'ovocyte lors de l'ovogenèse. Avant la fécondation, les ARNm de ces différents gènes sont distribués dans différentes régions. Ainsi, les ARNm Bicoïd sont ancrés dans la partie antérieure, les ARNm Nanos sont fixés au cytosquelette dans la région postérieure et les ARNm des gènes Hunchback et Caudal sont distribués le long de l'axe antéro-postérieur. Lors de la fécondation, ces différents ARNm se traduisent en protéines et forment des gradients de concentration.
Au niveau de la partie antérieure de l’ovule, la protéine Bicoïd inhibe la traduction de l’ARNm du gène Caudal en se liant à une séquence spécifique au niveau de sa région non traduite 3’UTR. Ce gène est responsable du développement de la région postérieure chez l’embryon. Ainsi, Caudal n’est traduit que dans la région postérieure et le gène Bicoïd détermine ainsi la région antérieure de l’ovule. Toujours dans la partie antérieure, Bicoïd agit sur le gène Hunchback, un gène responsable de la formation des segments du corps. La protéine (bcd) s’y lie au niveau de son amplificateur, une séquence régulatrice dans la molécule d’ADN, afin de stimuler sa transcription en ARNm. Ceci provoque donc l’augmentation de la concentration des protéines Hunchback dans la région antérieure, ce qui active la formation des segments thoraciques. Au niveau de la partie postérieure, la traduction de l’ARNm Hunchback est inhibée par la protéine Nanos avec l’assistance de la protéine Pumilio.
Les quatre gradients de protéines sont donc mis en place chez l’embryon précoce : Bicoïd et Hunchback concentrés dans la région antérieure et Nanos et Caudal dans la partie postérieure. Ces protéines (Bicoïd, Caudal et Hunchback) vont agir comme des facteurs de transcriptions afin de réguler l’expression des gènes zygotiques[13].
Les gènes-gap responsables de la formation et du développement de la tête ont une très faible affinité pour la protéine Bicoïd. Ces gènes sont : Empty spirales, Buttonhead et Orthodenticle[14]. La forte concentration de ce morphogène à l’extrémité antérieure de l’ovule augmente donc son affinité pour les promoteurs de ces gènes-gap. Toutefois, la transcription s’initie qu’en présence de la protéine Hunchback[13].
Mutations et leurs effets sur le développement de la partie antérieure chez l'embryon
Mutation du gène Bicoïd
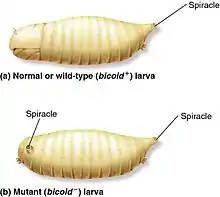
Chez la drosophile, le nom donné aux gènes correspond dans la majorité des cas à leurs phénotypes mutants[5]. Les embryons produits par une femelle ayant une mutation homozygote (une mutation au niveau des deux allèles du gène) du gène Bicoïd sont dépourvus des structures antérieures, c’est-à-dire qu’ils ne possèdent ni tête ni thorax. Ces structures dans ce cas-ci sont remplacés par des structures abdominales ce qui fait que l’embryon aura deux extrémités postérieurs, d’où le nom du gène Bicoïd qui signifie «deux extrémités» en grec[13] - [5].
Mutation des gènes Exuperantia et Swallow
Une mutation au niveau des gènes Exuperantia et Swallow a des répercussions indirectes sur la mise en place de la partie antérieure chez l'embryon. Ces deux gènes sont en effet responsables de l’ancrage de l’ARNm Bicoïd dans le cortex cellulaire au niveau de la région antérieure de l’ovocyte. Quand ils ne sont plus fonctionnels, l’ARNm Bicoïd va diffuser le long de l’ovule, jusqu’à la partie postérieure. Lors de la fécondation, la protéine (bcd) va être donc synthétisée le long de l’axe A/P et se sera dispersée aléatoirement dans toutes les régions de l'ovocyte. Ceci provoque la perte de du gradient de concentration de la protéine ; Bicoïd ne pourra alors plus agir comme un morphogène. Par conséquent, les gènes dont la transcription ne peut être initiée qu’en présence d’une certaine concentration de Bicoïd ne peuvent plus s’exprimer. C’est le cas notamment des gènes-gap, responsables de la formation de la tête, qui requièrent de très grandes concentrations de Bicoïd pour être transcrits. Cette mutation au niveau des gènes Exuperantia et Swallow va produire des embryons avec des phénotypes mutants dépourvus de la plupart des structures antérieures avec une bouche et un thorax élargis[13].
Voir aussi
Articles connexes
Liens externes
Notes et références
- Wolfgang Driever et Christiane Nüsslein-Volhard, « The bicoid protein determines position in the Drosophila embryo in a concentration-dependent manner », Cell, vol. 54, no 1, , p. 95–104 (DOI 10.1016/0092-8674(88)90183-3, lire en ligne, consulté le )
- Jamie M. Baird-Titus, Kimber Clark-Baldwin, Vrushank Dave et Carol A. Caperelli, « The Solution Structure of the Native K50 Bicoid Homeodomain Bound to the Consensus TAATCC DNA-binding Site », Journal of Molecular Biology, vol. 356, no 5, , p. 1137–1151 (DOI 10.1016/j.jmb.2005.12.007, lire en ligne, consulté le )
- Thomas Gregor, Alistair P. McGregor et Eric F. Wieschaus, « Shape and function of the Bicoid morphogen gradient in dipteran species with different sized embryos », Developmental Biology, vol. 316, no 2, , p. 350–358 (ISSN 1095-564X, PMID 18328473, PMCID PMC2441567, DOI 10.1016/j.ydbio.2008.01.039, lire en ligne, consulté le )
- Michael Stauber, Alexander Prell et Urs Schmidt-Ott, « A single Hox3 gene with composite bicoid and zerknüllt expression characteristics in non-Cyclorrhaphan flies », Proceedings of the National Academy of Sciences of the United States of America, vol. 99, no 1, , p. 274–279 (ISSN 0027-8424, PMID 11773616, DOI 10.1073/pnas.012292899, lire en ligne, consulté le )
- Lewis Wolpert, Cheryll Tickle et Alfonso Martinez Arias, Biologie du développement : Les grands principes, Dunod, , 792 p. (ISBN 978-2-10-076869-1, présentation en ligne)
- D. Ferrandon, L. Elphick, C. Nüsslein-Volhard et D. St Johnston, « Staufen protein associates with the 3'UTR of bicoid mRNA to form particles that move in a microtubule-dependent manner », Cell, vol. 79, no 7, , p. 1221–1232 (ISSN 0092-8674, PMID 8001156, lire en ligne, consulté le )
- (en) Daniela Lazzaretti, Katharina Veith, Katharina Kramer et Claire Basquin, « The bicoid mRNA localization factor Exuperantia is an RNA-binding pseudonuclease », Nature Structural & Molecular Biology, vol. 23, no 8, , p. 705–713 (ISSN 1545-9985, DOI 10.1038/nsmb.3254, lire en ligne, consulté le )
- (en) Frank Schnorrer, Kerstin Bohmann et Christiane Nüsslein-Volhard, « The molecular motor dynein is involved in targeting Swallow and bicoid RNA to the anterior pole of Drosophila oocytes », Nature Cell Biology, vol. 2, no 4, , p. 185–190 (ISSN 1476-4679, DOI 10.1038/35008601, lire en ligne, consulté le )
- « mRNA activation by polyadenylation », sur people.ucalgary.ca (consulté le )
- Daniel Boujard, Vincent Leclerc et Stéphane Vincent, Biologie du développement, Dunod, , 304 p. (ISBN 978-2-10-075101-3, présentation en ligne)
- X. Ma, D. Yuan, K. Diepold et T. Scarborough, « The Drosophila morphogenetic protein Bicoid binds DNA cooperatively », Development (Cambridge, England), vol. 122, no 4, , p. 1195–1206 (ISSN 0950-1991, PMID 8620846, lire en ligne, consulté le )
- Dierk Niessing, Wolfgang Driever, Frank Sprenger et Heike Taubert, « Homeodomain Position 54 Specifies Transcriptional versus Translational Control by Bicoid », Molecular Cell, vol. 5, no 2, , p. 395–401 (DOI 10.1016/S1097-2765(00)80434-7, lire en ligne, consulté le )
- (en) Scott F. Gilbert, « The Origins of Anterior-Posterior Polarity », NCBI, (lire en ligne, consulté le )
- (en) U. Grossniklaus, K. M. Cadigan et W. J. Gehring, « Three maternal coordinate systems cooperate in the patterning of the Drosophila head », Development, vol. 120, no 11, , p. 3155–3171 (ISSN 0950-1991 et 1477-9129, PMID 7720559, lire en ligne, consulté le )