Aluminate de lithium
L'aluminate de lithium est un composé chimique de formule LiAlO2. Il s'agit d'un solide blanc insoluble dans l'eau. Sa phase γ normale présente une structure cristalline tétragonale dans le groupe d'espace P41212 (no 92). Il existe également un polymorphe α ayant une structure cristalline trigonale dans le groupe d'espace R3m (no 166) semblable à celle du bifluorure de sodium (en)[4] NaHF2. Le système Li2O-Al2O3 contient, outre Li2O·Al2O3 décrit dans cet article, les composés Li5AlO4 (5 Li2O·Al2O3) et LiAl5O8 (Li2O·5 Al2O3)[5].
| Aluminate de lithium | |
| |
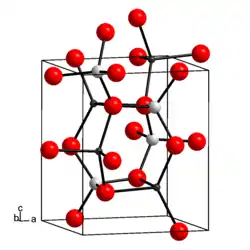
| __ Li+ __ Al3+ __ O2− Maille cristalline de l'aluminate de lithium |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.031.291 |
| No CE | 234-434-9 |
| PubChem | 123268 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | AlLiO2 |
| Masse molaire[1] | 65,921 ± 0,003 g/mol Al 40,93 %, Li 10,53 %, O 48,54 %, |
| Propriétés physiques | |
| T° fusion | > 1 625 °C[2] |
| Masse volumique | 2,615 g·cm-3[3] à 20 °C |
| Précautions | |
| SGH[3] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir de l'aluminate de lithium en faisant réagir de l'oxyde d'aluminium Al2O3 avec du carbonate de lithium Li2CO3 à une température de 870 à 970 K. La phase γ peut être obtenue de manière irréversible par frittage de la phase α à 1 350 °C[5]. Il est également possible d'utiliser un procédé sol-gel à partir de chlorure d'aluminium AlCl3 et de carbonate de lithium, ou de partir d'une solution d'hydroxyde de lithium LiOH avec de la boehmite γ-AlO(OH) et de procéder à une évaporation suivie d'une calcination à 900 °C[6].
L'aluminate de lithium est utilisé comme support interte pour électrolyte dans les piles à combustible à carbonate fondu[7], dans lesquelles les électrolytes peuvent être un mélange de carbonate de lithium, de carbonate de potassium K2CO3 et de carbonate de sodium Na2CO3. Il est également utilisé comme substrat pour les semiconducteurs en nitrure de gallium GaN[8] - [9]. Le polymorphe γ a été étudié pour la génération de tritium destiné à des réacteurs de fusion nucléaire[10] - [11]. Cette phase présente une stabilité à la fois thermique, physique, mécanique et radiologique qui la rend intéressante pour les applications nucléaires[12].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Lithium aluminum oxide », sur Alfa Aesar (consulté le ).
- Fiche Sigma-Aldrich du composé Lithium aluminate, consultée le 19 juin 2020.
- (en) M. Marezio, « The crystal structure and anomalous dispersion of γ-LiAlO2 », Acta Crystallographica, vol. 19, , p. 396-400 (DOI 10.1107/S0365110X65003511, lire en ligne)
- (en) James F. Shackelford et Robert H. Doremus, Ceramic and Glass Materials Structure, Properties and Processing, Springer Science & Business Media, 2008, p. 59. (ISBN 978-0-387-73362-3)
- (en) Jian CHENG, Liejin GUO, Shisen XU, Ruiyun ZHANG et Chen LI, « Submicron γ-LiAlO2 Powder Synthesized from Boehmite », Chinese Journal of Chemical Engineering, vol. 20, no 4, , p. 776-783 (DOI 10.1016/S1004-9541(11)60248-6, lire en ligne)
- (en) Leszek Suski et Miroslawa Tarniowy, « The phase stability of solid LiAlO2 used for the electrolyte matrix of molten carbonate fuel cells », Journal of Materials Science, vol. 36, , p. 5119-5124 (DOI 10.1023/A:1012425324262, lire en ligne)
- (en) Takafumi Yao et Soon-Ku Hong, Oxide and Nitride Semiconductors Processing, Properties, and Applications, Springer Science & Business Media, 2009, p. 229. (ISBN 978-3-540-88847-5)
- (en) Hadis Morkoç, Handbook of Nitride Semiconductors and Devices, Materials Properties, Physics and Growth, John Wiley & Sons, 2009, p. 382. (ISBN 3-527-62846-0)
- (en) J. Charpin, F. Botter, M. Briec, B. Rasneur, E. Roth, N. Roux et J. Sannier, « Investigation of γ lithium aluminate as tritium breeding material for a fusion reactor blanket », Fusion Engineering and Design, vol. 8, , p. 407-413 (DOI 10.1016/S0920-3796(89)80140-1, lire en ligne)
- (en) Yoshinori KAWAMURA, Masabumi NISHIKAWA, Kenichi TANAKA et Hiroyuki MATSUMOTO, « Adsorption Characteristics of Water Vapor on Gamma-Lithium Aluminate », Journal of Nuclear Science and Technology, vol. 29, no 5, , p. 436-444 (DOI 10.1080/18811248.1992.9731549, lire en ligne)
- (en) Richard Dronskowski, « Reactivity and acidity of Li in lithium aluminum oxide (LiAlO2) phases », Inorganic Chemistry, vol. 32, no 1, , p. 1-9 (DOI 10.1021/ic00053a001, lire en ligne)