Acide tungstique
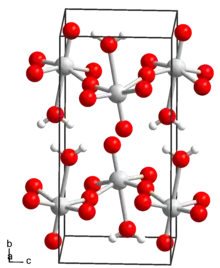
L'acide tungstique est un composé chimique de formule généralement écrite H2WO4. S'agissant d'un hydrate du trioxyde de tungstène WO3, il peut être écrit WO3·H2O ; on connaît également le dihydrate WO3·2H2O, ou H4WO5. Il n'existe cependant pas sous forme de molécules discrètes H2WO4, mais plutôt comme un cristal hydraté formé de couches d'unités WO5(H2O) à coordination octaédrique partageant quatre sommets[4]. Le dihydrate présente la même structure, avec les molécules d'eau supplémentaires intercalées entre les couches.
| Acide tungstique | |
| |
| __ W6+ __ O2− __ H+ Structure cristalline de l'acide tungstique |
|
| Identification | |
|---|---|
| Synonymes |
acide orthotungstique, |
| No CAS | |
| No ECHA | 100.029.068 |
| No CE | 231-975-2 |
| PubChem | 1152 |
| ChEBI | 36272 |
| SMILES | |
| InChI | |
| Apparence | poudre jaune inodore[1] |
| Propriétés chimiques | |
| Formule | H2O4W |
| Masse molaire[2] | 249,85 ± 0,01 g/mol H 0,81 %, O 25,61 %, W 73,58 %, |
| Propriétés physiques | |
| Solubilité | Insoluble dans l'eau |
| Masse volumique | 5,5 g·cm-3[3] à 25 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Le monohydrate est un solide jaune cristallisé insoluble dans l'eau. Ses sels sont appelés tungstates et contiennent l'anion WO42−.
L'acide tungstique a été découvert en 1781 à Köping par Carl Wilhelm Scheele. On peut l'obtenir par acidification de solutions de tungstates et en chauffant très doucement le dihydrate WO3·2H2O ainsi précipité. Une réaction possible consiste à traiter du tungstate de calcium CaWO4 par un mélange d'acide chlorhydrique HCl concentré et d'acide nitrique HNO3 :
Notes et références
- « Fiche du composé Tungstic(VI) acid », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Tungstic acid 99%, consultée le 9 février 2019.
- (en) A. F. Wells, Structural inorganic chemistry, 5e édition, Clarendon Press, Oxford, 1986. (ISBN 0-19-855370-6)