3'-Phosphoadénosine 5'-phosphosulfate
La 3'-phosphoadénosine 5'-phosphosulfate, dont l'anion est couramment abrégé en PAPS, est un dérivé de l'AMP phosphorylé en position 3' et avec un groupe sulfate sur le phosphate de la position 5'. C'est une coenzyme des phosphotransférases.
| 3'-Phosphoadénosine 5'-phosphosulfate | |
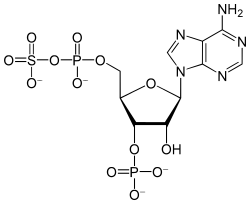 Structure de la 3'-phosphoadénosine 5'-phosphosulfate |
|
| Identification | |
|---|---|
| Synonymes |
PAPS, |
| No CAS | |
| No ECHA | 100.222.927 |
| PubChem | 10214 |
| ChEBI | 17980 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H15N5O13P2S [Isomères] |
| Masse molaire[1] | 507,264 ± 0,019 g/mol C 23,68 %, H 2,98 %, N 13,81 %, O 41 %, P 12,21 %, S 6,32 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'adénosine 5'-phosphosulfate, notée APS, est une variante de la PAPS non phosphorylée en 3'[2].
Elle intervient dans la biosynthèse des glycosaminoglycanes, importants composants de la matrice extracellulaire.
Métabolisme chez les bactéries sulfatoréductrices
L'APS et la PAPS sont des intermédiaires de la conversion des sulfates SO42− en sulfites SO32−, réduction exothermique réalisée par les bactéries sulfatoréductrices. L'anion sulfate joue, chez ces organismes, le rôle d'accepteur d'électrons dévolu, chez les organismes aérobies, à l'oxygène O2. Le sulfate n'est pas réduit directement mais résulte de la formation préalable d'APS ou de PAPS par réaction avec l'ATP, catalysée par l'ATP sulfurase :
La conversion de l'APS en PAPS est catalysée par l'adénylylsulfate kinase (EC ) :
La réduction de l'APS conduit à l'anion sulfite, dont la réduction se poursuit jusqu'au sulfure d'hydrogène H2S, qui est excrété. La réduction de la PAPS conduit également au sulfure d'hydrogène, mais ce dernier est alors utilisé pour les biosynthèses de l'organisme en question, par exemple pour synthétiser de la cystéine, un acide aminé soufré[3].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) M. Negishi, L. G. Pedersen, E. Petrotchenko et al., « Structure and function of sulfotransferases », Arch. Biochem. Biophys., vol. 390, no 2, , p. 149-157 (PMID 11396917, DOI 10.1006/abbi.2001.2368)
- (en) M. T. Madigan, J. M. Martinko, J. Parker, Brock Biology of Microorganisms, Prentice Hall, 1997 (ISBN 0-13-520875-0)