1-méthylpseudouridine
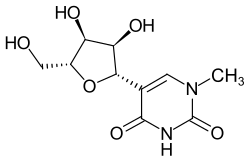
La 1-méthylpseudouridine ou N1-méthylpseudouridine (notée m1Ψ ou N1mΨ) est un ribonucléoside et un dérivé de la pseudouridine où l'hydrogène de l'azote 1 a été substitué par un groupe méthyle[2].
| 1-Méthylpseudouridine | |
| |
| Identification | |
|---|---|
| Nom UICPA | 5-[(2S,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1-methylpyrimidine-2,4-dione |
| Synonymes |
N1-méthylpseudouridine, N(1)-méthylpseudouridine, N1mΨ, m1Ψ |
| No CAS | |
| PubChem | 99543 |
| ChEBI | 19068 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H14N2O6 [Isomères] |
| Masse molaire[1] | 258,228 ± 0,011 2 g/mol C 46,51 %, H 5,46 %, N 10,85 %, O 37,18 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La méthylpseudouridine est naturellement présente dans l’ARN ribosomal des eucaryotes[3]. Son utilisation dans les vaccins à ARN en substitution des résidus uridine tend à améliorer leur efficacité en réduisant leur immunogénicité et en augmentant le rendement en protéines[4] - [5]. Cette molécule est utilisée dans l'ARN messager du vaccin de Pfizer-BioNtech[6] et du vaccin de Moderna contre la Covid-19[7].
Utilisation dans les vaccins à ARN
L’ARN exogène non modifié est reconnu par les récepteurs de type Toll et RIG-1 du système immunitaire inné. L’ajout de bases modifiées, naturellement présentes dans les ARN humains, permet de réduire considérablement ce phénomène et prévient ainsi le risque de réaction allergique à l’administration du vaccin[8]. La synthèse de la protéine vaccinale s’en trouve également améliorée étant donné que la réaction immunitaire innée tend à inhiber la traduction[4].
La méthylpseudouridine s'est imposée dans le champ des thérapies à ARN en raison de ses meilleures performances par rapport à d'autres bases modifiées[9] - [7]. Son utilisation permet en effet une production de protéines plus élevée que celle de la pseudouridine[5] - [9], ainsi qu'une moindre activation immunitaire[9].
Propriétés biochimiques
La méthyl-pseudouridine inhibe la reconnaissance de l'ARN par le récepteur TLR7[4] et déstabiliserait les structures secondaires reconnues par les récepteurs TLR3 et RIG-1[4]. D'autres résultats suggèrent que l'ARN contenant de la méthylpseudouridine se lie fortement à RIG-1, mais que ce dernier n'est pas activé[10]. La méthylpseudouridine pourrait également réduire la production d'ARN double brin, reconnu par le TLR3, lors de la production du vaccin[4]. En plus de contrecarrer la reconnaissance immunitaire, la méthylpseudouridine pourrait améliorer directement la traduction en favorisant le recrutement des ribosomes et en augmentant la demi-vie de l'ARN[11]. La contribution exacte de chacun de ces mécanismes aux propriétés de la méthylpseudouridine n’est toutefois pas connue avec certitude[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Fiche PubChem CID 99543.
- R C Brand, J Klootwijk, R J Planta et B E H Maden, « Biosynthesis of a hypermodified nucleotide in Saccharomyces carlsbergensis 17S and HeLa-cell 18S ribosomal ribonucleic acid », Biochemical Journal, vol. 169, no 1, , p. 71–77 (ISSN 0264-6021, DOI 10.1042/bj1690071, lire en ligne, consulté le )
- (en) Kellie D. Nance et Jordan L. Meier, « Modifications in an Emergency: The Role of N1-Methylpseudouridine in COVID-19 Vaccines », ACS Central Science, vol. 7, no 5, , p. 748–756 (ISSN 2374-7943 et 2374-7951, PMID 34075344, PMCID PMC8043204, DOI 10.1021/acscentsci.1c00197, lire en ligne, consulté le )
- (en) Callum J. C. Parr, Shunsuke Wada, Kenjiro Kotake et Shigetoshi Kameda, « N 1-Methylpseudouridine substitution enhances the performance of synthetic mRNA switches in cells », Nucleic Acids Research, vol. 48, no 6, , e35 (ISSN 1362-4962, PMID 32090264, PMCID 7102939, DOI 10.1093/nar/gkaa070, lire en ligne, consulté le ).
- (en) OMS MedNet, « Messenger RNA encoding the full-length SARS-CoV-2 spike glycoprotein » [archive] (consulté le ).
- (en) Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt et Heleen Dewitte, « The dawn of mRNA vaccines: The COVID-19 case », Journal of Controlled Release, vol. 333, , p. 511–520 (ISSN 0168-3659, DOI 10.1016/j.jconrel.2021.03.043, lire en ligne, consulté le )
- (en) Katalin Karikó, Michael Buckstein, Houping Ni et Drew Weissman, « Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA », Immunity, vol. 23, no 2, , p. 165–175 (ISSN 1074-7613, DOI 10.1016/j.immuni.2005.06.008, lire en ligne, consulté le )
- (en) Oliwia Andries, Séan Mc Cafferty, Stefaan C. De Smedt et Ron Weiss, « N1-methylpseudouridine-incorporated mRNA outperforms pseudouridine-incorporated mRNA by providing enhanced protein expression and reduced immunogenicity in mammalian cell lines and mice », Journal of Controlled Release, vol. 217, , p. 337–344 (ISSN 0168-3659, DOI 10.1016/j.jconrel.2015.08.051, lire en ligne, consulté le )
- Ann Fiegen Durbin, Chen Wang, Joseph Marcotrigiano et Lee Gehrke, « RNAs Containing Modified Nucleotides Fail To Trigger RIG-I Conformational Changes for Innate Immune Signaling », mBio, vol. 7, no 5, , e00833–16 (ISSN 2150-7511, PMID 27651356, PMCID 5030355, DOI 10.1128/mBio.00833-16, lire en ligne, consulté le )
- (en) Svitkin Yuri V. et al., « N1-methyl-pseudouridine in mRNA enhances translation through eIF2α-dependent and independent mechanisms by increasing ribosome density », Nucleic Acids Research, (lire en ligne)