Éfavirenz
L'éfavirenz (EFV) est un médicament antirétroviral, analogue non nucléosidique inhibiteur de la transcriptase inverse (nNRTI), utilisé pour le traitement de l'infection par le VIH. Cette molécule est commercialisée sous le nom de Sustiva ou Stocrin et est disponible sous forme de comprimés ou de capsules.
| Éfavirenz | |
| |
| Identification | |
|---|---|
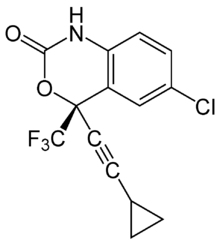
| Nom UICPA | (S)-6-chloro-4-(cyclopropyléthynyl) -1,4-dihydro-4-(trifluorométhyl) -2H-3,1-benzoxazin-2-one |
| Synonymes |
EFV |
| No CAS | |
| No ECHA | 100.149.346 |
| Code ATC | J05 |
| DrugBank | D00896 |
| PubChem | 64139 |
| ChEBI | 119486 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H9ClF3NO2 [Isomères] |
| Masse molaire[1] | 315,675 ± 0,015 g/mol C 53,27 %, H 2,87 %, Cl 11,23 %, F 18,06 %, N 4,44 %, O 10,14 %, |
| pKa | 10,2 |
| Propriétés physiques | |
| T° fusion | 137,2 ± 1,4 °C |
| Considérations thérapeutiques | |
| Voie d’administration | orale, i.v. |
| Grossesse | classe D |
| Antidote | aucun |
| Unités du SI et CNTP, sauf indication contraire. | |
Mécanisme d’action
L’éfavirenz agit comme un inhibiteur sélectif non nucléosidique de la transcriptase inverse du virus de l’immunodéficience humaine de type-1 (VIH-1). Il agit de façon non compétitive contre la transcriptase inverse du VIH-1. Ni la transcriptase inverse du VIH de type 2, ni les polymérases cellulaires alpha (α), bêta (β), gamma (γ) et delta (δ) ne sont affectées par les concentrations utilisées en clinique.
Pharmacocinétique
Absorption
Lors de tests sur des patients séronégatifs, la concentration plasmatique maximale est atteinte dans les 5 heures suivant l’administration d’une dose unique par voie orale. Les tests ont été effectués avec des doses variant de 100 mg à 1 600 mg.
Effet des aliments sur l’absorption
La prise d’une capsule de 600 mg d’éfavirenz avec un repas riche en matières grasses et en calories et un repas pauvre en matières grasses et équilibré en calories, provoque une augmentation de 39 % et de 51 %, respectivement, de la concentration maximale d’éfavirenz dans le sang par rapport à un état à jeun et la prise d’une capsule de 600 mg d’éfavirenz.
La prise d’un comprimé de 600 mg d’éfavirenz avec un repas riche en matières grasses et en calories provoque une augmentation de 79 % de la concentration maximale d’éfavirenz dans le sang par rapport à un état à jeun et la prise d’un comprimé de 600 mg d’éfavirenz.
Métabolisme
L’éfavirenz est principalement métabolisé par le cytochrome P450 dans le foie. Il est métabolisé en métabolites hydroxylés, qui sont de nouveau métabolisés en glucuronides. Ces métabolites ne présentent aucune action contre le VIH-1. Selon des études in vitro, les isoenzymes CYP3A4 et CYP2B6 sont, en premier lieu, responsables de la métabolisation de l’éfavirenz. Si la concentration d’éfavirenz est de 82 à 160 µM, il se peut qu’il inhibe les isoenzymes CYP2D6 et CYP1A2.
Un des avantages de l’éfavirenz est qu’il induit les enzymes du cytochrome P450 et donc son propre cycle de métabolisation. L’utilisation répétée de l’éfavirenz réduit son temps de demi-vie terminale d’environ 10 à 20 heures par rapport à une dose unique.
Élimination
L’éfavirenz possède une longue demi-vie terminale de 52 à 76 heures après l’administration d’une seule dose, mais de 40 à 55 heures après l’administration de doses multiples. Une étude d’une durée d’un mois pour vérifier la quantité résiduelle et la quantité éliminée (excrétée). Des sujets ont des doses de 400 mg d’éfavirenz par jour, la 8e dose a été marqué au 14C. une proportion d’éfavirenz radiomarqués a été trouvée dans l’urine et dans les fèces entre 14 à 34 % et 16 à 61 %, respectivement. Dans l’urine, il s’agit entièrement de métabolite et dans les fèces la majorité est de l’éfavirenz.
Données démographiques
La pharmacocinétique de l’éfavirenz ne semble être affectée ni par le sexe ni par l’origine de la personne.
Effets secondaires[2] - [3]
Voici un résumé non exhaustif des principaux problèmes liés à l’utilisation chez l’humain d’éfavirenz. L’éfavirenz a fait l’objet d’études chez 9 200 patients et en association avec quelques autres médicaments (indivanir, zidovudine et lamivudine) .
Troubles neuropsychiatriques
53 % des patients qui ont utilisé, lors de l’étude, l'éfavirenz ont déclaré avoir des symptômes. Les plus communs sont des céphalées, des vertiges, de l’insomnie. Des symptômes plus graves, tels que des troubles dépressifs sont parfois observés. En règle générale, ces troubles surviennent dans les suites de la première ou deuxième prise et s'estompent au décours du premier mois de traitement.
Éruption cutanée
Il s’agit d’une éruption maculopapuleuse légère à modérée. Habituellement l’éruption cutanée apparait après 1 à 2 semaines et disparait en moins d’un mois même si on continue le traitement. Il est conseillé d’arrêter le traitement à l’éfavirenz si l’éruption cutanée est importante, s’il y a formation de phlyctène, si des muqueuses sont touchées ou s’il y a de la fièvre. Les éruptions cutanées de grade 2 sont les plus communes lors de la prise d’éfavirenz.
Virologie
Résistance
Lors de test in vitro, des isolats du VIH-1 développent une sensibilité moindre, au-delà de 380 fois de la concentration inhibitrice 90 %, à l’éfavirenz très rapidement si en contact dans les milieux de culture cellulaire. Des mutations surviennent surtout dans la transcriptase inverse de seulement 1 à 3 acides aminés. Une autre étude a montré que lors d’une trithérapie avec éfavirenz, indivanir ou zidovudine et Lamivudine la transcriptase inverse subit des mutations à différents endroits. La plus fréquente, au-delà de 90 %, est le changement d’une tyrosine en asparagine en position 103.Durant cette étude, seulement une perte de sensibilité de 47 fois supérieures à celle de concentration inhibitrice 90 % a été observé.
Il arrive souvent que lorsqu’une souche du VIH-1 est résistante à l’éfavirenz, les autres inhibiteurs non nucléosidiques de la transcriptase inverse soient inefficaces. Il s’agit d’une résistance croisée, mais ce type de résistance n’est pas absolue dans le cas de l’éfavirenz. Des isolats cliniques du VIH-1 résistants à la zidovudine et insérés dans des cultures cellulaires semblent avoir conservé une bonne sensibilité à l’éfavirenz. Cela est dû au fait que les 2 médicaments agissent sur deux cibles différentes.
Toxicologie
Toxicité aiguë
La dose létale minimale (DLmin) obtenue chez la rate est de 250 mg·kg-1 à 500 mg·kg-1, jusqu'à 1 000 mg·kg-1 pour le rat. Les symptômes les plus visibles sont l’ataxie et une perte de l’activité motrice. Comme le temps de demi-vie est plus long chez l’humain, le modèle d’étude du rat n’est pas le plus approprié.
Toxicité à long terme
Des effets sur des rats, des singes rhésus et des macaques de Buffon ont été observés.
Chez le rat ont été observés des effets toxiques sur le néphron, comme une insuffisance rénale, une dégénérescence tubulaire, une nécrose légère du cortex rénal et des lésions rénales. Les doses administrées étaient de l’ordre de 250 mg·kg-1, 2 fois par jour pour la rate et au moins 500 mg/kg, 2 fois par jour. Pour les singes rhésus et les macaques de Buffon, aucun effet néphrologique n’a été observé. Les doses administrées étaient de l’ordre de 75 à 100 mg/kg, 2 fois par jour. Fait important, les concentrations plasmiques d’éfavirenz étaient plus élevées chez les primates que chez les rats.
Des malformations sur des fœtus ont été constatées chez 3 des 20 nouveau-nés chez les macaques de Buffon. Les mères porteuses recevaient une dose équivalente à 600 mg par jour chez l’humain.
Divers
L'éfavirenz fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[4].
Liens externes
- Compendium suisse des médicaments : spécialités contenant Éfavirenz
- Format PDF, sur le site du CHU de Toulouse Inhibiteur non nucléosidique de la reverse transcriptase.
- Site Catie
- Format PDF, sur le site de la FDA
La question du brevet
Le brevet de l'éfavirenz, détenu par la société Merck jusqu'en 2012, a été contourné le par le Brésil, qui a promulgué une licence obligatoire pour permettre la fabrication d'un générique sur son territoire[5].
Notes
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Michael S. Abers, Wayne X. Shandera et Joseph S. Kass, « Neurological and psychiatric adverse effects of antiretroviral drugs », CNS drugs, vol. 28, , p. 131–145 (ISSN 1172-7047, PMID 24362768, DOI 10.1007/s40263-013-0132-4, lire en ligne, consulté le )
- A. M. Mills, A. Antinori, B. Clotet et J. Fourie, « Neurological and psychiatric tolerability of rilpivirine (TMC278) vs. efavirenz in treatment-naïve, HIV-1-infected patients at 48 weeks », HIV medicine, vol. 14, , p. 391–400 (ISSN 1468-1293, PMID 23298380, DOI 10.1111/hiv.12012, lire en ligne, consulté le )
- WHO Model List of Essential Medicines, 18th list, avril 2013
- (en) « Le Brésil passe outre à un brevet sur un médicament contre le VIH »