Trifluorure d'iode
Le trifluorure d'iode est un interhalogène très instable de formule chimique IF3. Il se présente comme un solide jaune qui se décompose au-dessus de −28 °C par dismutation en iode I2 et pentafluorure d'iode IF5. La molécule présente une géométrie en T que la théorie VSEPR permet d'expliquer[2] par la présence de deux doublets non liants sur l'atome d'iode. Ces doublets repoussent les deux liaisons axiales I–F vers la liaison équatoriale I–F en formant un angle de 80,1° entre ces liaisons ; les liaisons axiales ont une longueur de 198 pm tandis que la liaison équatoriale a une longueur de 187 pm.
| Trifluorure d'iode | |
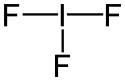  Structure du trifluorure d'iode |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | 13932268 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | IF3 |
| Masse molaire[1] | 183,899 68 ± 3,0E−5 g/mol F 30,99 %, I 69,01 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le tridluorure d'iode peut être produit par réaction des éléments, mais le produit formé est contaminé par le pentafluorure d'iode IF5. On peut également l'obtenir par réaction de l'iode I2 avec le difluorure de xénon XeF2 dans le trichlorofluorométhane CCl3F :
Le trifluorure d'iode est un agent de fluoration moins puissant que le trifluorure de brome BrF3 et le trifluorure de chlore ClF3.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann 2e édition, 1997. (ISBN 0-08-037941-9).