Tetraoninae
Les tétras, lagopèdes et gélinottes (Phasianidés, sous-famille des Tétraoninés) sont un groupe de Galliformes de taille moyenne à grande, adaptés aux zones tempérées et boréales de l’Hémisphère Nord. Certaines espèces sont connues pour leurs parades collectives. Vingt espèces sont actuellement acceptées, quatre existent en France, le grand tétras, le tétras lyre, le lagopède alpin et la gélinotte des bois.

Histoire naturelle
Caractéristiques morphologiques
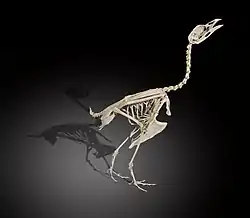
Les principales caractéristiques morphologiques des Tétraoninés résident dans leur adaptation à des conditions hivernales rigoureuses. Elles sont la présence de plumes sur les narines et les tarses, de pectinations cornés sur les doigts, à l’exception de Bonasa sewerzowi et des trois espèces du genre Lagopus, chez lesquelles les doigts sont emplumés. Cette adaptation leur permet d’avoir une meilleure portance sur la neige. Leur plumage est épais, les protégeant des basses températures. Leur bassin est large et aplati en raison de l’important développement de leur système intestinal. Les cæcums sont très développés, permettant à l'aide de bactéries la digestion d’éléments peu nutritifs tels que la cellulose[1] - [2].
On observe également chez certaines espèces du genre Lagopus (sauf L. lagopus scoticus) une variation saisonnière du plumage, variant deux à trois fois par an. Ces oiseaux, aux teintes brunes-grises l’été, deviennent blanc l’hiver, certainement pour accentuer leur mimétisme face aux prédateurs.
D’un point de vue biométrique, les tétras sont des oiseaux de taille moyenne à grande, les plus petites espèces sont Bonasa bonasia et Lagopus leucurus dont le poids minimal des femelles est de 300-330 grammes respectivement, la plus grande est Tetrao urogallus dont le poids des mâles peut atteindre 4800 grammes[2].
Répartition
Les Tétraoninés sont des oiseaux habitant les régions froides de l’Hémisphère Nord, incluant l’Eurasie et l’Amérique du Nord. Chaque espèce est propre à un continent, seul Lagopus lagopus et L. mutus sont largement distribuées dans les zones boréales de l’Europe l’Asie et l’Amérique du Nord. La troisième espèce du genre n’est présente que dans le Néarctique. Seul deux autres genres (Bonasa et Falcipennis) sont à la fois présents en Eurasie et en Amérique du Nord. Les genres Centrocercus, Dendragapus et Tympanuchus sont propres au Néarctique et les genres Lyrurus et Tetrao n’existent qu’au Paléarctique[2].
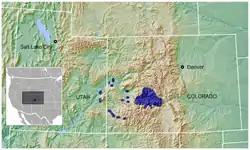
L’espèce la plus largement distribuée est Lagopus lagopus, dont l’aire s’étend de l’Irlande, l’Écosse et la Scandinavie jusqu’au Québec et la Terre de Feu, incluant une grande partie du Nord de l’Asie et l’Amérique du Nord. La plus localisée est Centrocercus minimus, seulement connu du Sud-ouest du Colorado et du Sud-est de l’Utah, aux États-Unis. D’autres espèces sont assez localisées, telles que Bonasa sewerzowi, présente dans le centre de la Chine, Lyrurus mlokosiewiczi, propre au Caucase, Tympanuchus cupido et T. pallidicinctus dans le centre des États-Unis.
Le peintre William Turner réalisa dans la paroisse de Beamsley dans le Yorkshire du Nord, fin 1816, une aquarelle intitulée Chasse à la grouse sur Beamsley Beacon, Angleterre, conservée à la Wallace Collection à Londres[3].
Lagopus mutus est l’espèce la plus septentrionale, atteignant les rives nord du Groenland, les plus méridionales sont en Amérique du Nord Tympanuchus cupido, atteignant le Golfe du Mexique et en Eurasie Bonasa sewerzowi en Chine[2] - [4].
Habitat
Les Tétraoninés habitent les régions froides de l’Hémisphère Nord. Les genres Centrocercus, Lagopus, Tympanuchus préfèrent des habitats ouverts, les genres Dendragapus et Lyrurus des habitats semi-ouverts et les genres Bonasa, Falcipennis et Tetrao des habitats fermés[2].

Dans leur aire de répartition, on trouve Lagopus mutus et L. leucurus dans des toundras alpines et arctiques, à végétation rase entrecoupée de rochers. L. lagopus est certainement le tétras tolérant la plus importante diversité d’habitats, allant de toundras ou landes ouvertes à habitats semi-boisés à dominance de feuillus. Les espèces du genre Bonasa habitent des forêts feuillues ou mixtes, avec une forte présence de Bétulacées.
Les genres Falcipennis et Tetrao occupent des forêts mixtes ou à dominance de Pinacées très marquée, alors que les espèces des genres Dendragapus et Lyrurus préfèrent des zones de transitions entre landes et forêts, essentiellement résineuses. Le genre Tympanuchus habite les landes et prairies herbeuses à proximité de boisements arbustifs clairs. Les espèces du genre Centrocercus préfèrent des landes semi-arbustives d’armoises (Astéracées)[2].
Les tétras, lagopèdes et gélinottes sont des oiseaux résidents, à l’exception de Lagopus mutus en Amérique du Nord et de Tympanuchus cupido qui peuvent effectuer d’importants déplacements hivernaux, pouvant atteindre respectivement 2000 et 400 kilomètres vers le sud[2].
Comportement

Reproduction
Chez les Tétraoninés, le ratio des sexes est de 1/1 environ. La plupart des espèces sont polygames, à l’exception des espèces Bonasa bonasia et B. sewerzowi, exclusivement monogames et du genre Lagopus, dont certains mâles peuvent être polygames[2]. Dans le cas des espèces monogames, le mâle établi un territoire et le défend alors que la femelle s’occupe de la nidification et de l’élevage des jeunes.

On distingue deux types de comportement chez les espèces polygames. Dans le premier cas, les mâles se réunissent sur une aire de parade collective (lek) où chaque individu effectue une danse nuptiale destinée à attirer les femelles et à s’accoupler. Une fois la période d’accouplement terminée, les individus se dispersent et seules les femelles s’occupent de leur descendance. C’est le cas des espèces des genres Centrocercus, Lyrurus, Tetrao et Tympanuchus.
Le second cas est plus ou moins intermédiaire entre les précédents, le mâle établi un territoire et parade seul afin d’attirer les femelles et s’accoupler. Après cette phase, les femelles fécondées se dispersent et nichent à proximité des territoires des mâles. C’est le cas de Bonasa umbellus, des genres Dendragapus et Falcipennis et dans une moindre mesure des espèces Lagopus lagopus et L. mutus.
Pour toutes les espèces, la période des parades et accouplement se fait à la fin de l’hiver, c’est-à-dire de février à juin selon les espèces et régions. La femelle fait son nid à terre, à l’abri d’un buisson ou d’une aspérité d’un relief. Le nid est très rudimentaire, mais la femelle est protégée par sa livrée mimétique avec le biotope. Elle pond 4 à 18 œufs selon les espèces, la durée d’incubation est de 20-25 jours. Les poussins sont nidifuges mais restent « en famille » durant une durée de 2,5 à 3 mois avant leur dispersion[1] - [2].
.jpg.webp)
Systématique et évolution
Les tétras, lagopèdes et gélinottes appartiennent à l'ordre des Galliformes (Temminck, 1820) et à la famille des Phasianidae (Horsfield 1821)[5]. Les études génétiques modernes ont montré qu’ils forment un groupe monophylétique, considéré comme une sous-famille distincte, les Tetraoninae (Vigors, 1825) et proche du genre Meleagris (Gray, 1840)[6], bien que certains auteurs continuent à les traiter en une famille distincte[2].
Liste systématique
Les publications récentes admettent 20 espèces réparties en 8 genres[2] - [7]. La liste systématique suivante est issue de Del Hoyo et al[7].
- Genre Bonasa (Stephens, 1819), incl. Tetrastes (Keyserling & Blasius, 1840)
- Gélinotte des bois – Bonasa bonasia (Linnaeus, 1758), syn. Tetrastes bonasia, 12 sous-espèces
- Gélinotte de Severtzov – Bonasa sewerzowi (Przevalski, 1876), syn. T. sewerzowi, 2 sous-espèces
- Gélinotte huppée – Bonasa umbellus (Linnaeus, 1766), 16 sous-espèces
- Genre Centrocercus (Swainson, 1832)
 Tétras des armoises, Centrocercus urophasianus, mâle en parade, États-Unis.
Tétras des armoises, Centrocercus urophasianus, mâle en parade, États-Unis.- Tétras du Gunnison – Centrocercus minimus (Young, Braun, Oyler-McCance, Hupp & Quinn, 2000), monotypique
- Tétras des armoises – Centrocercus urophasianus (Bonaparte, 1827), monotypique
- Genre Dendragapus (Elliot, 1864)
- Tétras fuligineux – Dendragapus fuliginosus (Ridgway, 1873), 4 sous-espèces
- Tétras sombre – Dendragapus obscurus (Say, 1823), 4 sous-espèces
- Genre Falcipennis (Elliot, 1864), incl. Canachites (Stejneger, 1885)
- Tétras du Canada – Falcipennis canadensis (Linnaeus, 1758), syn. Canachites canadensis, 5 sous-espèces
- Tétras de Sibérie – Falcipennis falcipennis (Hartlaub, 1855), monotypique
- Tétras de Franklin – Falcipennis franklinii (Douglas, 1829), syn. C. franklinii, 2 sous-espèces
- Genre Lagopus (Brisson, 1760)
 Lagopède alpin, Lagopus mutus, mâle en plumage estival, Japon.
Lagopède alpin, Lagopus mutus, mâle en plumage estival, Japon.- Lagopède des saules – Lagopus lagopus (Linnaeus, 1758), incl. L. scoticus/scotica (Latham, 1787), 20 sous-espèces
- Lagopède à queue blanche – Lagopus leucurus (Richardson, 1831), syn. L. leucura, 5 sous-espèces
- Lagopède alpin – Lagopus mutus (Montin, 1781), syn. L. muta, 31 sous-espèces
- Genre Lyrurus (Swainson 1832)
- Tétras du Caucase – Lyrurus mlokosiewiczi (Taczanowski, 1875), syn. Tetrao mlokosiewiczi, monotypique
- Tétras lyre – Lyrurus tetrix (Linnaeus, 1758), syn. T. tetrix, 7 sous-espèces
- Genre Tetrao (Linnaeus, 1758)
- Tétras à bec noir – Tetrao urogalloides (Middendorff, 1853), syn. T. parvirostris (Bonaparte, 1856), 3 sous-espèces
- Grand tétras – Tetrao urogallus (Linnaeus, 1758), 13 sous-espèces
- Genre Tympanuchus (Gloger, 1841), incl. Pedioecetes (Baird, 1858)
- Tétras des prairies – Tympanuchus cupido (Linnaeus, 1758), incl. T. pinnatus (Brewster, 1885), 2 sous-espèces
- Tétras pâle – Tympanuchus pallidicinctus (Ridgway, 1873), monotypique
- Tétras à queue fine – Tympanuchus phasianellus (Linnaeus, 1758), syn. Pedioecetes phasianellus, 6 sous-espèces
L’espèce Centrocercus minimus a été découverte dans les années 1970, mais a été décrite en 2000. Cette espèce diffère de C. urophasianus par ses caractéristiques génétiques et biométriques, son plumage et son comportement nuptial[8]. La séparation des espèces Dendragapus fuliginosus et Falcipennis franklinii, autrefois considérées comme sous-espèces de D. obscurus et F. canadensis respectivement, est supportée par des analyses génétiques[9] - [10].
D'après certains auteurs, le nom Lagopus est féminin[11]. En conséquence, la plupart des publications récentes admettent les noms Lagopus leucura et L. muta, certaines sous-espèces ont également été renommées, par exemple L. lagopus scotica. Mais selon R. Potapov, le nom Lagopus est masculin[2], il est donc préférable de dire L. leucurus et L. mutus comme il fut anciennement noté.
La plupart des espèces de Tetraoninae sont largement distribuées et présentent une certaine variabilité dans leurs caractéristiques morphologiques, comportementales et/ou écologiques. Selon Del Hoyo et al., cinq espèces sont monotypiques, les autres sont divisées en 132 sous-espèces au total[7]. En réalité, beaucoup de ces sous-espèces sont douteuses et rien ne justifie leur reconnaissance, une réévaluation de ces dernières serait nécessaire[4].
Évolution
Jusqu’au Pléistocène inférieur, les restes fossiles de Tetraoninae sont rares et fragmentaires, probablement parce que les sols des milieux où vivent ces oiseaux, comme les forêts, sont peu propices à la fossilisation[2]. Les fossiles du Pléistocène provenant généralement de déchets alimentaires dans les sites habités par les hommes préhistoriques.
Plusieurs espèces fossiles datant du Miocène ont été identifiés comme des tétras, par exemple Palaealectoris incertus (Wetmore, 1930) et Tympanuchus stirtoni (Brodkorb, 1964) du Miocène inférieur ainsi que Archaeophasianus roberti (Stone, 1915) et A. mioceanus (Shufeldt, 1915) du Miocène supérieur. Leur attribution à cette sous-famille est aujourd’hui contesté[2] - [12].
L’origine des Tetraoninae semble beaucoup plus récente, les restes les plus anciens sont ceux de Tetrao rhodopensis (Boev, 1998) du Pliocène inférieur de Bulgarie et Lagopus atavus (Jánossy, 1974) du Pliocène inférieur de Bulgarie et supérieur de Pologne. D’autres restes proviennent du Pliocène supérieur et de l’ensemble du Pléistocène d’Europe et d’Asie alors que les plus anciens d’Amérique du Nord datent du Pléistocène inférieur[2]. Ce registre fossile indiquerait une origine eurasiatique des Tetraoninae[2] - [13], hypothèse en contradiction avec les données moléculaires qui situeraient cette apparition en Amérique du Nord[12].
Le clade monophylétique des Tetraoninae semble avoir divergé des autres Phasianidae, notamment de Meleagris gallopavo, il y a 6,3 millions d’années et la diversification des genres serait plus récente, entre 3 et 1 millions d’années environ[12]. L’arbre phylogénétique des tétras montre que la sous-famille se divise en quatre clades[6] - [9] :
- Clade 1) Le genre Bonasa est le plus basal, avec notamment l’espèce basale Néarctique B. umbellus et les Paléarctiques B. bonasia et B. sewerzowi ;
- Clade 2) Le genre Lagopus, avec l’espèce basale Néarctique L. leucurus et les deux Holarctiques L. lagopus et L. mutus, forme un second clade séparé des deux suivants ;
- Clade 3) Les genres Falcipennis, Lyrurus et Tetrao incluant les espèces basales Néarctiques F. franklinii et F. canadensis et 5 espèces Paléarctiques ;
- Clade 4) Les genres Centrocercus, Dendragapus et Tympanuchus incluant 7 espèces propres au Néarctique.
Il est donc suggéré que les tétras sont originaires d’Amérique du Nord, que certains clades se sont développés strictement en Amérique du Nord (4) et que d’autres sont originaires du Nouveau Monde mais se sont largement développés, lors d’immigrations successives par le détroit de Béring, vers l’Eurasie (1, 2 et 3). L’évolution, la diversification et l’expansion de la sous-famille des Tetraoninae est récente et largement corrélée aux variations climatique du Quaternaire[12].
Hybridations

Des hybrides entre la plupart des espèces de tétras ont été recensés dans la littérature, parfois même avec d’autres galliformes tel que le dindon (Meleagris gallopavo), le poulet (Gallus gallus), la perdrix grise (Perdrix perdrix) ou le faisan (Phasianus colchidus)[14]. De tels hybrides ont été obtenus principalement en captivité et sont douteux dans la nature.
Les hybridations naturelles entre les espèces de tétras sont rares dans la nature en raison de leurs différences écologiques et les oiseaux hybrides sont généralement infertiles[14]. Elles existent principalement entre espèces polygames de même dimensions et sont ponctuelles parmi les monogames. Elles sont principalement :
- Centrocercus urophasianus × Tympanuchus phasianellus
- Lagopus lagopus × mutus
- Lyrurus tetrix × Tetrao urogallus
- Tetrao urogalloides × urogallus
- Tympanuchus cupido × phasianellus
Les hybrides entre le grand tétras et le tétras lyre (dits Rackelhahn en allemand) sont connues depuis longtemps en Europe et en Russie, le phénomène est amplifié dans les régions où le grand tétras est en forte diminution d’effectifs. De même, l’hybridation entre le tétras des prairies et le tétras à queue fine a été favorisée par l’intensification des pratiques agricoles, réduisant ainsi les barrières écologiques de ces deux espèces[2].
Menaces, conservation
Les Tétraoninés sont des espèces très sensibles à toutes perturbations de leurs habitats. Ils sont ainsi considérés comme des bio-indicateurs de la qualité de ces derniers et leur conservation est donc importante[4].

Statuts de conservation
Du fait de leur large aire de présence mondiale, treize espèces sur vingt sont listées LC (préoccupation mineure) par l’UICN, bien que ce classement peut masquer des disparités régionales. Par exemple, le tétras lyre est largement distribué en Asie mais est en forte régression en Europe où son aire est très fragmentée[4]. Toutes ces espèces sont en régression à l'exception du tétras du Canada et du tétras de Franklin, dont les populations sont jugées stables[15].
La gélinotte de Severtzov, le tétras des armoises, le tétras de Sibérie et le tétras du Caucase sont listées NT (quasi-menacée). Le tétras des prairies et le Tétras pâle sont listés VU (vulnérable) et le tétras du Gunnison est listée EN (en danger). Ces sept espèces sont évaluées ainsi en raison de leur aire de répartition très localisée et/ou de la forte diminution de leurs effectifs[15].
Le grand tétras cantabrique (Tetrao urogallus cantabricus) est évalué EN et le tétras d’Attwater (Tympanuchus cupido attwateri) est listé CR (en danger critique)[4]. Le tétras cupidon (T. cupido cupido) s’est éteint en 1932 en raison de la modification de son habitat[4], mais la faible diversité génétique constatée d’après les spécimens de muséums a fortement contribué à son extinction[16].

Menaces

Mesures de conservation
Diverses mesures de protection sont envisageables pour maintenir en place les populations de tétras, lagopèdes et gélinottes[2] - [4] :
- La restauration des habitats favorables en adaptant les pratiques sylvicoles et agricoles. Par exemple, des actions de réouvertures de biotopes favorables au tétras lyre sont réalisées dans les Alpes[17] ;
- Le suivi des populations afin de surveiller leur tendance démographique et adapter les mesures de conservation ;
- La régulation de la chasse, en instaurant des plans de chasse et en interdisant le tir durant la période de reproduction, notamment pour les espèces paradant collectivement. Instaurer un statut de protection légal est particulièrement nécessaire pour toutes les espèces en danger et les pays où les populations sont en forte diminution ;
- La création de zones de protection dans des secteurs favorables aux espèces en essayant de créer une continuité entre ces espaces pour pallier l’isolement des populations. Ces zones de protections doivent également limiter les dérangements en interdisant le public en période hivernale et de reproduction ;
- L’élevage en captivité et la réintroduction de populations, voir des translocations, dont le succès dépend beaucoup de la qualité de l’habitat où le relâchement est effectué[4]. Le grand tétras a par exemple été réintroduit avec succès en Écosse en 1837. Des translocations ont été réalisées avec succès pour le tétras à queue fine aux États-Unis ou le lagopède alpin dans les Pyrénées[18] ;
- La sensibilisation et l’éducation du public aux diverses menaces pesant sur les espèces et les mesures de conservation ;
- Dans certains cas le contrôle des prédateurs.
Les tétras en France
Le grand tétras Tetrao urogallus est présent dans les Pyrénées ( sous-espèce Tetrao urogallus aquitanicus), le Jura et les Vosges, il a quasiment disparu des Alpes et des tentatives de réintroductions en Lozère ont été effectuées dès les années 1980[19]. L’espèce est listé VU dans la Liste rouge des espèces menacées de France, la sous-espèce pyrénéenne (T. urogallus aquitanicus) est signalée VU et celle des Vosges, du Jura et des Alpes (T. urogallus urogallus) notée NT[20]. La chasse au grand tétras est autorisée dans les six départements de la chaîne pyrénéenne où il est présent mais son tir est interdit dans l'ensemble des départements de l'est de la France où il existe encore.
Le tétras lyre Lyrurus tetrix a disparu des Ardennes à la fin des années 1990 mais est largement présent dans les Alpes, depuis le Var où sa présence est sporadique jusqu’à la Haute-Savoie[19]. L’espèce est listé LC dans la Liste rouge des espèces menacées de France[20]. La chasse au tétras lyre est autorisée dans tous les départements alpins à l'exception du Var et du Vaucluse (Haute-Savoie, savoie, Isère, Hautes-Alpes, Alpes-de-Haute-Provence, Alpes-maritimes).
Le lagopède alpin Lagopus mutus est présent en France uniquement dans les massifs des Alpes et des Pyrénées[19]. L’espèce est listé LC dans la Liste rouge des espèces menacées de France, la sous-espèce pyrénéenne (L. mutus pyrenaicus) est cependant signalée en NT[20]. La chasse au lagopède alpin est autorisée dans 11 des 13 départements où il est présent (sauf Aude et Drôme).
La gélinotte des bois Bonasa bonasia a disparu anciennement des Pyrénées, du Massif central et de la majeure partie des départements de plaine du nord-est de la France. Elle est encore présente dans les massifs des Vosges, du Jura et des Alpes, où a été constatée son apparition récente dans les Alpes-de-Haute-Provence[19]. L’espèce est listé VU dans la Liste rouge des espèces menacées de France[20]. La chasse à la gélinotte des bois est autorisée dans six départements en France (Jura, Ain, Haute-Savoie, Savoie, Isère, Hautes-Alpes).
Références
- Géroudet, P., Grands échassiers, gallinacés, râles d’Europe, Éditions Delachaux & Niestlé, Neuchâtel, , 430 p.
- Potapov R. & Sale R., Grouse of the world, New Holland Publishers, Londres, , 408 p.
- Aquarelle de Turner
- Storch I. (coord.), Grouse, status survey and conservation action plan 2006-2010, IUCN Species Survival Commission, , 112 p.
- « Peterson A. P. Birds of the World - current valid scientific avian names/Galliformes, version 10.106 », sur Zoological Nomenclature Resource (consulté le ).
- Dimcheff D. E., Drovetski S. V. & Mindell D. P., « Phylogeny of Tetraoninae and other galliform birds using mitochondrial 12S and ND2 genes », Molecular Phylogenetics and Evolution, vol. 24, no 2, , p. 203–215.
- « Del Hoyo J., Elliott A., Sargatal J., Christie D. A. & de Juana E. (coords.). HBW Alive. Lynx Edicions, Barcelone », sur Handbook of the Birds of the World Alive (consulté le ).
- Young J. R., Braun C. E., Oyler-McCance S. J., Hupp J. W. & Quinn T. W., « A new species of sage-grouse (Phasianidae: Centrocercus) from southwestern Colorado », Wilson Bulletin, vol. 112, no 4, , p. 445–453.
- Drovetski S. V., « Molecular Phylogeny of Grouse: Individual and Combined Performance of W-Linked, Autosomal, and Mitochondrial Loci », Systematic Biology, vol. 51, no 6, , p. 930–945.
- Barrowclough, G. F., Groth, J. G., Mertz, L. A., & Gutierrez, R. J., « Phylogeographic structure, gene flow and species status in Blue Grouse (Dendragapus obscurus) », Molecular Ecology, vol. 13, no 7, , p. 1911–1922.
- David M. & Gosselin M., « The grammatical gender of avian genera », Bulletin of the British Ornithologists' Club, vol. 122, no 4, , p. 257–282.
- Drovetski S. V., « Plio-Pleistocene climatic oscilations, Holarctic biogeography and speciation in an avian subfamily », Journal of Biogeography, vol. 30, no 8, , p. 1173–1181.
- Boev Z., « Tetraonidae VIGORS, 1825 (Galliformes – Aves) in the Neogene-Quaternary record of Bulgaria and the origin and evolution of the family », Acta Zoologica Cracoviensia, vol. 45 (Special Issue), , p. 263–282.
- Johnsgard, P. A., « Etho-Ecological Apects of Hybridization in the Tetraonidae », World Pheasant Association, vol. VII, , p. 42–57.
- « The IUCN Red List of Threatened Species, version 2015-4 », sur The IUCN Red List of Threatened Species (consulté le ).
- Johnson J. A. & Dunn P. O., « Low genetic variation in the Heath Hen prior to extinction and implications for the conservation of prairie-chicken populations », Conservation Genetics, vol. 7, no 1, , p. 37–48.
- Losinger I., Chautan M. & Magnani Y., « Pastoralisme et tétras-lyre », Faune sauvage, vol. 291, , p. 20–27.
- Novoa C., Bech N., Resseguier J., Martinez-Vidal R., Garcia Ferré D., Sola de la Torre J. & Boissier J., « A translocation experiment for improving the genetic diversity of an isolated population of Pyrenean rock ptarmigan (Lagopus muta pyrenaica) », Grouse News, Newsletter of the Grouse Group of the IUCN-SSC Galliformes Specialist Group, vol. 47, , p. 11–17.
- Buffet, N. & Dumont-Dayot E., « Evolution de la répartition communale du petit gibier de montagne en France : Décennie 2000–2009 », Faune sauvage, vol. 290 (supplément), , p. 1–16.
- U.I.C.N. France, M.N.H.N., L.P.O., S.E.O.F. & O.N.C.F.S., La Liste rouge des espèces menacées en France - Chapitre Oiseaux de France métropolitaine, UICN Paris, France, , 28 p.