Table des différents rapports observés en Chimie entre différentes substances
Table des rapports de Geoffroy
| Table des rapports | |
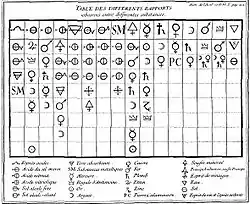 Table des différents Rapports observés en Chimie entre différentes substances | |
| Auteur | Étienne-François Geoffroy |
|---|---|
| Pays | France |
| Éditeur | Imprimerie royale, imprimerie Du Pont |
| Collection | Histoire de l'Académie royale des sciences |
| Lieu de parution | Paris |
| Date de parution | 1718 |
Le , le chimiste Étienne-François Geoffroy présente à l'Académie royale des sciences sa table des différents rapports observés en Chimie entre différentes substances[1] où il propose une classification des substances chimiques suivant leur plus ou moins grande « disposition à s'unir » à une substance de référence. L'idée que certaines substances puissent s'unir plus facilement que d'autres n'était pas nouvelle, mais le crédit de réunir toutes les informations disponibles dans un grand tableau général, appelé plus tard table d'affinité, en revient à Geoffroy[2].
Cette table qui ne ressemblait à rien d'autre publié auparavant en chimie, incita de nombreux chimistes à publier leurs propres tables d'affinité[2] dans les décennies suivantes. À la fin du siècle, Fourcroy un des premiers chimistes convertis aux vues de Lavoisier, écrira que la table de Geoffroy fit office de prototype pour les futures tables d'affinité et servit de « flambeau pour guider les chimistes » du XVIIIe siècle:
« Mais aucune découverte n'est plus éclatante dans cette époque des grands travaux... aucune enfin n'a conduit à des résultats plus importants que celle qui est relative à la détermination des affinités entre corps et à l'exposition des degrés de cette force entre les différentes substances naturelles. C'est à Geoffroy l'aîné,... qu'on doit cette belle idée de la table des rapports ou des affinités chimiques.... Cette idée lumineuse a servi de flambeau pour guider les pas des chimistes... »
— Encyclopédie méthodique. Chymie, pharmacie et métallurgie, Fourcroy[3], 1786, p. 333
Le rapport-affinité entre deux substances se présente non comme un objet de pensée spéculative mais comme le produit d'observations empiriques. Après l'échec du modèle corpusculaire « des pointes et des pores » de Lémery, Geoffroy propose une approche opératoire de l'union de deux substances qui pourrait avoir mis les chimistes de la fin du siècle sur la piste d'une notion correcte des corps composés et d'une nouvelle théorie des éléments, enfin satisfaisante[4]. Car pour classer hiérarchiquement les rapports-affinités entre substances, il utilise un test de déplacement d’une entité chimique par une autre, un phénomène chimique bien réel qui ne sera expliqué que beaucoup plus tard, aux XIXe – XXe siècles. La chimie délaisse alors le substantialisme des principes, et va définir les substances par leur circulation d’une combinaison à l’autre[5].
Le paradoxe de Geoffroy, c'est de combiner des conceptions alchimiques anciennes (fabriquer du fer par transmutation) et l'idée moderne de rapport-affinité entre substances, basée sur la seule observation. Le savant de la continuité n'était-il pas aussi porteur de la rupture lavoisienne qui s'annonçait ?
Principe de construction de la table
Geoffroy part de l'observation que tous les corps ne « s'unissent » pas entre eux et que parmi ceux qui s'unissent à un même corps, certains ont « plus de rapport d'union ou de disposition à s'unir » que d'autres. Pour classer cette plus ou moins grande disposition à s'unir, il procède à un test qu'il décrit ainsi :
« Toutes les fois que deux substances A et C qui ont quelque disposition à se joindre l’une à l’autre, se trouvent unies ensemble AC, s’il en survient une troisième B qui ait plus de rapport avec l’une des deux (par ex. A), elle s’y unit AB en faisant lâcher prise à l’autre C » Table p. 203[1]
Dans cette citation, c'est nous qui avons rajouté les symboles en bleu.
C’est-à-dire que si un corps B mis en présence d’une « union » de deux substances CA, déloge C pour donner la combinaison BA, on en conclut que le corps B a plus de rapport/affinité que le corps C pour le corps A:
- B+CA → BA (+ C)
B déplace C quand ce dernier est uni à A
La méthodologie de Geoffroy se comprend si on construit le tableau suivant : dans la première colonne, les substances sont classées dans l’ordre A, B, C sur la base des « unions » observées entre le référent A et les substances B et C, indiquées dans la deuxième colonne.
| A (référent) | « Union » avec A |
| B | BA existe, en gén. B+A → BA |
| C | CA existe, en gén. C+A → CA |
| B déplace C | B+CA → BA + C |
Lorsque B déplace C (lié à A), Geoffroy positionne B au-dessus de C dans la colonne de A de sa table de rapports.
En s’appuyant sur les sources de l’époque, il est possible de traduire les « équations » de Geoffroy en termes de réactions chimiques modernes et ainsi de comprendre comment les chimistes du XVIIIe siècle interprétaient ce qu’ils « voyaient ». Lorsque Geoffroy parle de l’ « union » AB d’un Esprit acide A à un Sel alkali[n 1] fixe B, les entités A et B peuvent désigner des corps composés dans le membre gauche et des ions dans le membre droit de l’équation. Ainsi en partant de l’esprit acide HCl et de l’alkali fixe KOH,
- A+B→AB se traduit par
- HCl + KOH → KCl + H2O
avec dans le membre gauche A=HCl et B=KOH alors que dans le membre droit A=Cl− et B=K+. La formation d’eau passe inaperçue, car la réaction se fait en milieu aqueux[n 2]. Le dégagement éventuel d’un gaz sera aussi ignoré. Dans certains cas, la réaction directe n'existe pas (l'acide chlorhydrique n'attaque pas l'argent, le cuivre et l'or), mais les sels peuvent être obtenus par d'autres réactions. C'est pourquoi nous mettons dans le tableau « CA (ou BA) existe ».
Ainsi Geoffroy, comme tous les chimistes du début du XVIIIe siècle croyait que dans la production d’un sel, les ingrédients de départ étaient conservés comme composants du sel[6]. Malgré tous ses efforts pour décrire ce qu’il voit de manière totalement neutre, sans le moindre présupposé théorique, les termes d’ « union », « jonction » et « séparation » qu’il emploie, laissent penser implicitement que la totalité des corps A et B sont unis alors qu’en fait, on sait maintenant que ce n’est qu’une partie des atomes constituants de A et de B qui entrent en jeu dans le composé AB produit. Une réaction chimique de A avec B est une réorganisation des éléments chimiques apportés par A et B; ce ne sont pas les réactifs qui sont conservés mais les éléments chimiques qui se lient de manière différente au cours de la transformation. Les chimistes de ce début du XVIIIe siècle, malgré tous leurs efforts pour se défaire de toutes les conceptions anciennes de la matière et leur exigence de ne s’appuyer que sur l’expérience, ne disposaient toujours pas d’une théorie des éléments satisfaisante qui leur aurait permis de rendre compte des faits observés de manière non distordue. On observe ainsi la maxime bien connue : il n’y a pas de faits bruts, les faits sont toujours construits. On s'aperçoit par la même occasion, que le vocabulaire de la langue commune n'est pas neutre car il ne dispose pas de terme technique précisément défini permettant d'indiquer exactement le type d'union.
La tentative de forger une théorie des éléments chimiques sur la base de la seule expérience chimique initiée par Paracelse (1493-1541) n’avait abouti après deux siècles d’efforts, qu’à proposer la conception que toutes les substances ne se composaient que de cinq éléments : l’esprit, l’huile, le sel, l’eau (ou phlegme) et la terre[n 3]. Au début du XVIIIe siècle, un retour surprenant à la théorie des Quatre éléments se fait en deux étapes; d'une part les travaux des chimistes allemands amènent à « considérer comme démontré présentement,& d’après les travaux Becher et Stahl, que l’eau, la terre et le feu, entrent véritablement dans la composition des corps » (Macquer[7], 1766) puis les travaux des chimistes britanniques Hales, Black et Priestley font connaître « l'air comme un principe ».
Ce n’est que Lavoisier qui réussira à sortir la recherche chimique de cette impasse, en transférant les mesures quantitatives très précises de la physique en chimie[8]. En , il synthétise de l’eau en enflammant de l’hydrogène et de l’oxygène et comprend qu’elle est composée de ces deux gaz (nommés respectivement l’air inflammable et l’air déphlogistiqué). L'eau n'est pas un élément mais un corps composé. Pourtant avant lui Cavendish avait déjà fait cette expérience mais l’adhésion à l’idée classique que l’eau était un élément (un corps simple) l’avait empêché de comprendre ce qu’il observait : il avait cru en toute bonne foie que l’eau était déjà présente dans les deux gaz. Il avait simplement cherché à « sauver » son observation en faisant une hypothèse simple à l’intérieur de son paradigme ; c’est ce que Thomas Kuhn[9] entend par « recherche normale ».
Geoffroy lui-même adhérait complètement à la théorie classique des éléments et avait même donné des mémoires où il expliquait comment synthétiser artificiellement du fer à partir de trois principes[10] (une « partie terreuse [qui] s'unit très étroitement avec quelque portion d'acide & de soufre »). Pourtant, pour construire sa table, il a dû se livrer des centaines de fois la gymnastique intellectuelle d'imaginer des substances faites d'une « union » d'un esprit acide et d'un sel alcali : comment alors n'a-t-il pas pu se persuader que son « union » aussi approximative fut-elle, approchait plus la réalité que celle proposée par la théorie classique des éléments ?
Bien que la conception de « l’union » et de la « séparation » des substances utilisée par Geoffroy ne fut pas complètement vraie, le déplacement d’une entité chimique par une autre que vise à mettre en évidence la table des rapports, est un phénomène chimique bien réel. Ou plus exactement, il s'explique par plusieurs phénomènes chimiques différents qui ne seront bien compris que beaucoup plus tard grâce aux théories des potentiels d’oxydoréduction[n 4], des couples acido-basiques[n 5] et de la solubilité[n 6]. Par contre, pour sauver le « rêve newtonien » de trouver des forces chimiques d'affinité, Marcelin Berthelot et Théophile De Donder introduiront (fin du XIXe - début du XXe) des notions thermodynamiques de fonction d'état permettant de prévoir le sens d'évolution d'une réaction chimique[11].
Le contenu de la table
Craignant d’être accusé de recourir à des forces d’attraction à distance, manifestation d'une sorte de propriété occulte proscrite par Descartes (reliant toutes choses comme les relations de sympathie et antipathie chez Paracelse ou della Porta), Geoffroy évite de parler d'« attraction » ou d'« affinité » de crainte de se faire taxer de newtonianisme. On se souvient qu'une dizaine d'années auparavant, il avait exposé devant l'Académie l'ouvrage de Newton, Optiks, qui contient à partir de l'édition de 1706 l'importante « Question 23 »[n 7] dans laquelle Newton propose une extension de l'attraction universelle aux phénomènes de la chimie[12].
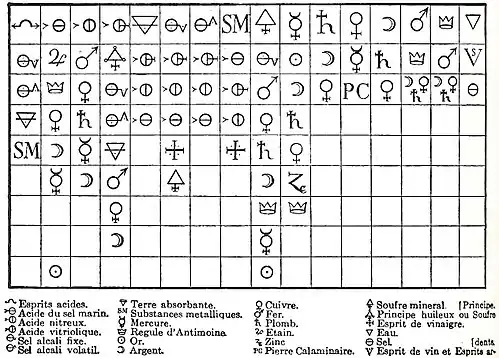
Les symboles sont inspirés de la tradition alchimique.
Les historiens de la chimie ne sont pas d'accord sur l'importance de l'influence de Newton sur Geoffroy et sur la chimie du XVIIIe siècle. Quant à lui, Geoffroy déclare avoir établi les rapports d’affinité uniquement sur une base empirique
- « J’expose aujourd’hui dans cette Table des différents rapports que j’ai recueillis tant des expériences & des observations des autres Chimistes que des miennes propres » Table[1] p. 203
malheureusement il n’indique jamais quelles expériences sont invoquées. Il précise cependant
- « Je donnerai par la suite, si on le juge à propos, toutes les expériences sur lesquelles sont fondées les rapports des différentes substances renfermées dans cette table,& qui m’ont déterminé à les ranger dans l’ordre où on les voit disposées » Table[1] p. 212.
Pour Geoffroy, cette table a un but pédagogique pour ceux « qui commencent à apprendre la chimie » et servira d'outil prédictif pour entreprendre une stratégie expérimentale et interprétatif pour les « opérations difficiles à démêler »[1].
La Table des différents rapports publiée par Geoffroy en 1718 comporte 16 colonnes et 24 symboles désignant 19 substances et 4 classes de substances (les métaux, les sels, les acides et les terres absorbantes).
Pour rendre plus lisible ce tableau, nous le reproduisons en remplaçant les symboles par leur nom dans la langue chimique du XVIIIe siècle, complété d'une formule chimique moderne pour les espèces chimiques et quelques exemples pour les classes. Pour la traduction des termes anciens dans la terminologie de la chimie moderne élaborée par une équipe autour de Lavoisier, on peut se reporter à la Méthode de nomenclature chimique, proposée par MM. de Morveau, Lavoisier, Bertholet & de Fourcroy[13] (1787), au Dictionnaire de Béguin[14] ou à l'Encyclopédie de Diderot et d'Alembert[15]. À cette époque la notion de sel était beaucoup plus large et vague qu'actuellement[12]. Il commençait à cesser d'être un principe de la matière, participant à la formation des mixtes. Geoffroy à la suite de Guillaume Homberg voyaient déjà un sel neutre comme un composé obtenu par l'union d'un acide avec toutes une série de substances interagissant avec lui, bien qu'il continuât à parler de sel alkali pour de simples alcalis (bases). En 1744, Rouelle donnera une définition claire et rigoureuse des substances nommées de nos jours « sels ».
| Table des rapports de Geoffroy I | |||||||
| 1.Esprits acides (Acides) | 2.Acide de sel marin (HCl) | 3.Acide nitreux (HNO3) | 4.Acide vitriolique (H2SO4) | 5.Terre absorbante (Chaux) | 6. Alcali fixe (Potasse) | 7. Alcali volatil (Ammoniaque) | 8.Substances métalliques // |
| Sel alcali fixe (potasse KOH, soude NaOH) | Étain Sn | Fer Fe | Principe huileux | Acide vitriolique H2SO4 | Acide vitriolique H2SO4 |
Acide vitriolique H2SO4 | Acide de sel marin |
| Sel alcali volatil (ammoniac NH3) | Antimoine Sb | Cuivre Cu | Alcali fixe | Acide nitreux (HNO3) | Acide nitreux (HNO3) | Acide nitreux (HNO3) | Acide vitriolique (H2SO4) |
| Terre absorbante (chaux, calcaire...) | Cuivre Cu | Plomb Pb | Alcali volatil | Acide de sel marin HCl | Acide de sel marin HCl | Acide de sel marin HCl | Acide nitreux (HNO3) |
| Substances métalliques | Argent Ag | Mercure Hg | Terre absorbante | Esprit de vinaigre CH3COOH) | Esprit de vinaigre | ||
| Mercure Hg | Argent Ag | Fer Fe | Principe huileux | ||||
| Cuivre Cu | |||||||
| Argent Ag | |||||||
| Or Au | |||||||
La première ligne contient toutes les substances de référence. Chaque colonne comporte dessous la substance de référence, toutes les substances susceptibles de s'unir à elle avec une affinité décroissante. La première colonne donne la préférence à l'union aux Esprits acides (les acides). Ainsi, Venel dans l'Encyclopédie de Diderot explique :
- « l'alkali fixe est dit avoir plus de rapport avec l'acide que l'alkali volatil, parce que si on applique l'alkali fixe à un corps formé par l'union de l'acide & de l'alkali volatil, l'alkali fixe dégage l'alkali volatil, & s'unit à l'acide en sa place » Encyclopédie[16].
Les colonnes 2, 3, 4 donnent les préférences pour l’union à l’acide chlorhydrique, nitrique et sulfurique, suivies des colonnes 5 à 7 qui donnent les préférences pour les alkalis (matières réagissant avec effervescence lors de leur dissolution par un acide[12]). La colonne 8 reprend les divers acides vus dans les colonnes 1 à 4 mais en les classant par rapport aux métaux. Les huit colonnes suivantes concernent le principe huileux, les métaux et la dernière assez singulière concerne l'eau.
| Table des rapports de Geoffroy II | |||||||
| 9.Principe huileux | 10.Mercure Hg | 11.Plomb Pb | 12. Cuivre Cu | 13. Argent Ag | 14.Fer Fe | 15.Antimoine Sb | 16.Eau H2O |
| Alkali fixe | Or | Argent | Mercure | Plomb | Sb | Fer | Esprit de vin, esprits ardents |
| Fer | Argent | Cuivre | Pierre calaminaire Zn | Cuivre | Ag, Cu, Pb | Ag, Cu, Pb | Sel |
| Cuivre | Plomb | ||||||
| Plomb | Cuivre | ||||||
| Argent | Zinc | ||||||
| Antimoine Sb | Sb | ||||||
| Mercure | |||||||
| Or | |||||||
La table de Geoffroy ne reçut pas immédiatement l'adhésion de tous les académiciens. Fontenelle rendit compte de cet accueil mitigé en ces termes « Ces Affinités firent de la peine à quelques-uns, qui craignirent que ce ne fussent des Attractions déguisées, d'autant plus dangereuses, que d'habiles gens ont déjà su leur donner des formes séduisantes »[17].
On reprocha aussi à la table d’affinité d’être une simple liste de réactions sans aucune théorie sous-jacente. Mais c’était précisément ce que son auteur voulait : fournir un large corpus de faits sans aucun présupposé théorique[2]. Ne pas supposer connu ce qui ne l'était pas.
La base empirique de la table
Ursula Klein a montré que toutes les transformations chimiques décrites dans la table des rapports, peuvent être reliées à des opérations pratiques effectuées durant le XVIIe siècle en pharmacie, minéralogie, métallurgie et dans les artisanats traditionnels[6]. L'originalité de Geoffroy est d'essayer de rassembler cette profusion d'informations de manière compacte, tout comme les naturalistes, submergés par l'augmentation considérable des plantes nouvellement connues dans le monde, tentèrent les premières classifications méthodiques au tournant des XVIIe – XVIIIe siècles[18] - [n 8].
Nous examinerons deux grands types d'expériences[11]:
- les déplacements d'un métal par un autre métal dans une solution saline
- des doubles décompositions par action d'un acide, d'une base ou d'un sel sur un autre sel
Déplacement d'un métal par un autre métal
Chaque colonne de la table demanderait une analyse détaillée précise. Nous nous arrêterons un peu sur la troisième colonne qui concerne l'acide nitrique (nommée acide nitreux par Geoffroy). Depuis longtemps les (al)chimistes[n 9] utilisaient cet acide pour dissoudre l'argent. Albert le Grand au XIIIe siècle, avait observé que l’acide nitrique pouvait séparer l’or de l’argent en dissolvant l’argent. Les chimistes du XVIIe siècle, comme Christophe Glaser ou Nicaise Le Febvre décrivent aussi comment « L’argent dissout dans l’eau forte... se précipite et se sépare [de son dissolvant] par le moyen d’une plaque de cuivre que l'on y met »[19]. Le Cours de chymie (fin du XVIIe) de Nicolas Lémery, une véritable synthèse des connaissances empiriques de l'époque, donne comme à son habitude, une description claire et précise des opérations à effectuer :
- « faites dissoudre une ou deux onces d’argent de coupelle, dans deux ou trois fois autant d’esprit de nitre : versez votre dissolution dans une petite cucurbite en verre, et au feu de cendres très lent, faites évaporer environ la quatrième partie de l’humidité…il se formera des crystaux que vous séparez de l’humidité;...
lorsque les acides commencent à pénétrer le corps de l’argent, il se fait une ébullition accompagnée d’une chaleur très considérable parce que ses pointes rompent les obstacles qui les empêchaient d’entrer… fait sortir par le col du vaisseau, une vapeur ou fumée rouge qu’on doit éviter comme très nuisible à la poitrine » Cours de chymie[20] p. 89
La formation de nitrate d'argent AgNO3 s'accompagne de la production d'un gaz de monoxyde d'azote NO qui au contact de l'air donne du dioxyde d'azote NO2 de couleur brun rougeâtre. Un peu plus loin, Lémery explique comment le cuivre déplace l'argent :
- « si on veut revivifier ces crystaux en argent, il ne faut que les jeter dans de l’eau tiède & y ajouter une plaque de cuivre : ils se fondront alors & l’argent précipitera au fond en une poudre blanche » p.92
Ces informations suffisent à expliquer que le cuivre est au-dessus de l'argent dans la troisième colonne de la table des rapports de Geoffroy.
| 3e colonne Acide nitreux A |
Geoffroy dixit | Interprétation |
| Cuivre B (Cu) | A+B → AB | 8 HNO3 + 3 Cu(s) → 3 Cu2+ + 6 NO3− + 2 NO(g) + 4 H2O NO + 1/2 O2 → NO2 |
| Argent C (Ag) | A+C → AC | 4 HNO3 + 3 Ag(s) → 3 AgNO3(aq) + NO(g) + 2 H2O AgNO3 → Ag+ + NO3− Solubilité(AgNO3)=2340 g/L à 25 °C |
| Cu déplace Ag+ | B + AC → AB + C | Cu(s) + 2 AgNO3(aq) → 2 Ag(s) + Cu(NO3)2(aq) |
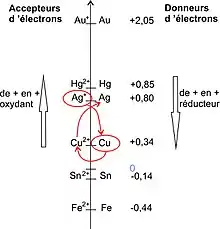
Le cuivre dégage l'argent de son sel (en rouge)
La liste des formes réduites des métaux (dans la partie droite), lue de bas en haut, correspond à la liste de la colonne 2 de la table de Geoffroy
La dernière réaction est totale c'est-à-dire que la réaction inverse n'est pas possible et l'argent ne déplace pas le cuivre spontanément. Ces propriétés indépendantes des anions (venant des acides) sont actuellement expliquées par la théorie des potentiels d'oxydoréduction[21]. En deux mots, la réaction de déplacement de l'argent par le cuivre s'explique par un échange d'électrons entre les deux couples oxydant-réducteur Ag+/Ag et Cu2+/Cu. La réaction
- 2 Ag+ + Cu(s) → 2 Ag(s) + Cu2+
est favorable parce que le potentiel standard du couple engageant la forme oxydée Ag+ est supérieur au potentiel standard du couple engageant la forme réduite Cu, initialement introduite. En toute rigueur, il faut tenir compte des concentrations initiales des solutés, mais dans le cas général, on peut s'appuyer sur la liste de potentiels standard.
L'objectif de l'historien n'est pas d'évaluer les résultats scientifiques du passé, mais de faire saisir combien certains travaux ont su dégager du fatras des données d'observation un phénomène réel. Car l'enjeu est de savoir quelles problématiques sont fructueuses sur le long terme et quelles autres engagent la recherche dans des impasses.
Substitution et précipitation
La méthode de classification des substances de Geoffroy posait plusieurs défis à la communauté des chimistes du XVIIIe siècle qui ne purent tous être relevés de la même manière. Voyons par exemple, la classification de « l'affinité » des bases (les alcalis fixes et volatils, et les terres absorbantes) pour les acides, donnée dans la première colonne.
La position de l'alcali volatil (ammoniac) en-dessous de l'alcali fixe (soude par ex.) est basée sur des opérations chimiques comme la décomposition du sal armoniac (terme de Lémery pour NH4Cl) par addition d'alcali fixe, suivie d'une distillation[6]. Nicolas Lémery consacre le chapitre XVII de son Cours à l'origine égyptienne et aux divers traitements de ce sel[22].
Les éléments de la première colonne sont des classes d'espèces chimiques (acides, bases et métaux) et non pas des substances spécifiques. Un très grand nombre de cas sont possibles, nous allons nous arrêter au cas particulier suivant :
| Esprits acides A=HCl | |
| Alcali fixe B=NaOH | HCl + NaOH → NaCl + H2O |
| Alcali volatil C=NH3 |
HCl(aq) + NH3(aq) = NH4Cl(aq) NH4Cl(s) = NH4+(aq) + Cl−(aq) |
| B déplace C | NaOH + NH4Cl = NaCl + NH3 + H2O |
L'ion sodium Na+ de l'alcali fixe se substitue à l'ammonium du sel de l'alcali volatil (le sel ammoniac) pour donner du chlorure de sodium. Ce dernier se récupère par précipitation. Il est préférable que les réactifs soient en proportion stœchiométrique, équimolaires. À cette époque, des chimistes comme Lémery, pesaient attentivement toutes les substances et sans connaitre la stœchiométrie, employaient souvent des proportions stœchiométriques correctes[23].
Toutes les possibilités de réactions de déplacement ne sont pas aussi facilement testables que le cas du sel ammoniac. D'ailleurs les collègues chimistes de Geoffroy ne se privèrent pas de lui faire remarquer. Il dut répondre à leurs objections en mars 1720 dans un mémoire intitulé Éclaircissements sur la Table insérée dans les Mémoires de 1718[24] :
« Une des premières objections qui m'ait été faites, regarde l'ordre des rapports inséré dans la première colonne de cette Table. J'y ai établi que les Terres absorbantes ont un moindre rapport avec les acides que les sels alkalis, soit fixes, soit volatils. Suivant cela, toute Terre absorbante ne doit avoir aucune action sur les acides joints avec les sels alkalis. On m’objecte qu’on éprouve tous les jours que la Chaux (qu’on regarde ordinairement comme une Terre absorbante) se joint aux acides, quoiqu’ils soient unis avec des alkalis volatils,& qu’elle les en détache. C’est ce qu’on prétend démontrer dans le mélange qu’on fait de la Chaux & du Sel ammoniac pour en retirer l’esprit volatil urineux »
Il s'agit de la préparation d'une solution d'ammoniaque à partir de sel ammoniac :
- Ca(OH)2 + 2 NH4Cl → CaCl2 + 2 H2O + 2 NH3(g)
Le cation calcium Ca++ (la terre abs.) déplace l'ion ammonium NH4+ (l'alkali volatil) de « l'acide joint à l'alkali volatil ». L'objection est donc valable. Mais le chlorure de calcium CaCl2(s) est soluble dans l'eau
- CaCl2(s) = Ca2+ (aq) + 2 Cl−(aq)
Pour le faire précipiter, on peut rajouter du calcaire (soient des ions Ca2+ qui font déplacer la réaction dans le sens inverse). On remarquera qu'il est difficile de parler d'une manière générale de la précipitation d'un sel sans connaitre sa concentration et ses constantes caractéristiques, la solubilité S et la constante de dissociation Kd.
Geoffroy accepte l'objection et répond que la chaux n'est probablement pas une simple Terre absorbante.
En fait, on perçoit sur cet exemple toutes les difficultés de disposer d'un test opératoire pour un chimiste de l'époque qui n'avait que très peu de moyens pour identifier une substance. Pour une réaction en milieux aqueux, il était essentiel que la production de sel soit accompagnée d'un dégagement gazeux ou de la formation d'eau - deux substances non prises en compte. D'autre part pour mettre en évidence le sel, il fallait le faire précipiter. Autant de contraintes, qui auraient nécessité de préciser les conditions expérimentales de température, concentrations etc.
D'autre part, un certain nombre de réactions de déplacement sont des équilibres (et non des réactions totales). On peut donc s'en servir pour argumenter aussi bien que B déplace C que l'inverse C déplace B, en jouant sur les conditions expérimentales. Dans ce cas, il n'y a plus de hiérarchie qui vaille.
Dans les décennies qui vont suivre, les chimistes vont abondamment avoir recours aux tables d’affinité et vont être amenés à lancer de nombreuses recherches pour comprendre les phénomènes de dissolution et de précipitation. Ainsi, Rouelle définira le point de saturation et classera les sels neutres sur le critère du faciès des cristaux, du degré de chaleur d’évaporation etc.
La vogue des tables d'affinité
À la suite de la publication de la table des rapports en 1718, les chimistes émirent quelques critiques auxquelles Geoffroy s'empressa de répondre dans son mémoire Éclaircissements[24] de 1720, mais aucun chimiste ne proposa de nouvelle table dans la décennie qui suivie. Par contre entre 1730 et 1790, une vingtaine de chimistes publièrent les tables suivantes répertoriées par Duncan[2]:
- 1730, Jean Grosse, table[25] de 19 colonnes, avec des symboles
- 1749, Clausier, donne des listes de produits par ordre d'affinité[26]
- 1751, Gellert[27], métallurgiste allemand, fournit une table de 28 colonnes, avec des symboles
- 1756, D. A. Rüdiger[28], table de 25 colonnes, avec symboles
- 1758, Jean-Philippe de Limbourg[29], table des affinités semblable à celle de Gellert, à 33 colonnes, avec symboles
- 1762, Marherr, table de 120 colonnes, montrant l'ordre d'affinité de deux substances avec une troisième, avec symboles
- 1763, Rouelle, table publiée dans l'Encyclopédie de Diderot, sans mention d'auteur, table de 19 colonnes, avec symboles
- 1763, Spielmann, Institution de chimie, Strasbourg, table de 28 colonnes, avec symboles
- 1769, Jacques François Demachy[30], table de 20 colonnes, avec symboles
- 1773, Inconnu, ouvrage imprimé à l'Imprimerie Royale, référé par Demachy
- De Fourcy, table de 36 colonnes, en mots
- 1775, Erxleben, 36 listes séparées, en mots
- 1775, Bergman, table par voie sèche et table par voie humide, 59 substances, avec symboles
- 1777, Weigel, distingue par les voies sèche et humide, pas en colonne, en mots
- 1781, Wiegleb, distingue la voie sèche et humide et les réactions impliquant deux, trois ou plus de substances
- 1788, Berkenhout, version courte de la table de Bergman
- 1790, Gergens et Hochheimer, table de 49 colonnes, distinguant les voies sèches et humides.
- 1790, Gren, 11 sections pour les substances non préparées séparément; 76 sections pour les substances préparées séparément
En 1783, Lavoisier observe quelques défauts des tables auxquels il propose diverses corrections[31]. « Une table d'affinités ne peut donc présenter des résultats vrais qu'à un certain degré de chaleur, et le mercure en fournit un exemple frappant ». Si l'on chauffe le mercure jusqu'à sa température d'ébullition, il se combine à l'oxygène (2Hg + O2→2 HgO) ; « veut-on lui faire éprouver une chaleur un peu plus forte », l'oxygène se dégage et le métal se revivifie (2 HgO→ 2 Hg + O2). Lavoisier est d'accord avec Bergman pour distinguer les tables présentant les résultats soit par voie sèche soit par voie aqueuse. Et pour obtenir des tables complètement en accord avec l'expérience, « il faudrait, pour ainsi dire, en former une pour chaque degré du thermomètre ». « Un second défaut de nos tables d'affinités est de ne faire entrer pour rien les effets de l'attraction de l'eau ». On sait maintenant que les concentrations jouent un rôle important dans la précipitation.
Pour étudier la combustion, Lavoisier chauffe de l'oxyde de mercure (HgO) dans un ballon, en présence de charbon de bois. Il observe que l'oxyde rougeâtre se transforme peu à peu en mercure métallique et que du gaz carbonique est produit
- 2 HgO + C → 2 Hg + CO2
On observe que « le carbone C déplace le mercure Hg ». Lavoisier propose de classer les substances susceptibles de s'unir à l'oxygène suivant l'ordre de leur affinité. Il s'agit d'une seule colonne commençant par principe oxygine (oxygène) puis
- Substance charbonneuse, Zinc, Fer...Cobalt, Nickel, Plomb,...Acide nitreux, Chaux de manganèse.
L’élaboration du concept de corps composé
Alors que depuis plus de deux siècles, la théorie des éléments/principes n’avait pas réussi à être réformée de manière satisfaisante et que le concept de mixte[32] avait peu évolué, brusquement au milieu du XVIIIe siècle, surgit Lavoisier, qui en quelques années met à bas la théorie classique des éléments et propose une nouvelle conception des corps composés. La Terre, l'Eau, l'Air et le Feu ne sont pas des éléments : l'eau est un corps composé formé d'oxygène et d'hydrogène, l'air est un mélange d'au moins deux gaz, l'oxygène et d'azote. Les deux concepts de base (l'eau et l'air) de la théorie classique des quatre éléments sont complètement anéantis : le premier devient un corps pur composé, le second un mélange de deux corps purs. Et par la même occasion, le vénérable concept aristotélicien de mixte éclate en corps composé et mélange ! Lavoisier était certainement un esprit supérieur mais le terrain n’était-il pas préparé par les travaux de ses prédécesseurs ?
Geoffroy suppose que dans la réaction d’un acide sur une base (ou un métal), les substances de départ sont conservées dans le sel produit. En effet, il ignorait que de l’eau ou un gaz puissent être formés, donc tous les réactifs de départ devaient se retrouver dans le produit final apparent. Même si la granularité des éléments conservés n’était pas la bonne, cette idée a peut-être contribué, à l’émergence du concept de corps composé[4].
La notion de mixte, utilisée jusque-là était bâtie sur la théorie des quatre éléments héritée de l’Antiquité ou d’une théorie étendue à l’esprit, l’huile, le sel, l’eau (ou phlegme) et la terre. Mais la méthode de « réduction des mixtes en leurs constituants » étant basée essentiellement sur la distillation, ne pouvait conduire qu’à une impasse, car elle permettait d’analyser seulement les mélanges liquides et non les corps composés - les deux formes communes des mixtes. Par contre les relations d'affinité établies par le phénomène de déplacement d'une entité dans une union, replaçait l'analyse au niveau des corps composés[4].
Par la très riche expérience acquise dans les manipulations de laboratoire, les chimistes du XVIIe siècle qui s’étaient peu à peu convaincus que les diverses versions de la théorie des éléments/principes n’étaient pas opératoires, se tournèrent à la fin du siècle vers les modèles corpusculaires et mécanistes. Nicolas Lémery proposa alors son « modèle des pointes et des pores » qui connut en son temps un grand succès: les sels sont formés par la jonction de particules pointues (acide) qui pénètrent dans les pores des particules de l’alcali (la base).
Même si ce modèle sera abandonné au siècle suivant, il a certainement contribué à concevoir un sel comme un corps composé, formé de constituants ayant la taille des réactifs de départ (l’effervescence de la réaction était vue comme la résultante de la brisure de certaines pointes qui pénétraient les pores). Nous sommes donc avec une granularité des constituants n’ayant rien à voir avec les éléments principiels.
Avec sa théorie des rapports, Geoffroy fait un pas en avant de plus. Il n’a certes, pas de modèle aussi parlant à l’esprit mais il peut proposer une approche empirique du problème : les corps s’unissent s’ils ont un « rapport » une « disposition à s’unir ». Et ce « rapport/affinité » est une notion purement empirique contrairement au modèle corpusculaire de nature totalement spéculative, impossible à tester. Là où Lémery imaginait des pointes et des pores de tailles et de formes différentes pour moduler les différents types de réaction, Geoffroy n’a rien à imaginer, il n’a qu’à se reporter aux faits d’observation sur les différents degrés de « disposition à s’unir ».
Notes
- les deux orthographes alcali et alkali sont actuellement valides (cf. CNRT). Geoffroy employait celle avec le k ; celle avec le c est devenue plus commune à partir du XIXe siècle
- ce qui explique que les chimistes parlent de A=Cl− comme de l'acide du sel (H+ étant ignoré) et de B=K+ comme de la base du sel (OH+ étant ignoré)
- voir le Cours de chimie (1646) d'Étienne de Clave ou le Cours de chymie (1675-1757) de Nicolas Lémery
- ce n'est qu'en 1843 qu'Arrow commence à comprendre le fonctionnement d'une pile électrique
- Joannes Brønsted formule sa théorie des acides en 1923
- la théorie du produit de solubilité est proposée par W. Nernst en 1889
- plus connue sous le numéro 31 de la seconde édition anglaise de 1717
- Joseph Pitton de Tournefort (1656-1708) publie en 1694 Éléments de botanique dans lequel il tente une classification des plantes basée sur les caractères de la fleur, plus d'un demi-siècle avant le Species plantarum de Carl von Linné
- cette graphie, introduite par Didier Kahn, vise à rappeler qu'au XVIIe siècle, il n'existe pas de différention entre chimie et alchimie, cf. Plantes et médecine, (al)chimie et libertinisme chez Guy de la Brosse
Références
- Geoffroy l'Aîné, « Table des différents rapports observés en Chimie entre différentes substances », dans Collectif, Histoire de l'Académie royale des sciences, avec les mémoires de mathématique et de physique, Paris, chez Gabriel Martin, J-B Coignard fils, H. L. Guerin, (lire en ligne)
- A.M. Duncan, « Some theoretical aspects of eighteenth-century tables of affinity—I », Annals of Science, vol. 18, no 3,
- Fourcroy, Antoine-François, « Chimie », dans Collectif, Encyclopédie méthodique. Chymie, pharmacie et métallurgie. Tome 3, Paris, chez Panckoucke, (lire en ligne), p. 333
- Ursula Klein, « Origin of the Concept of Chemical Compound », Science in Context, vol. 7, no 2,
- Bernadette Bensaude-Vincent, Lavoisier, Flammarion, Paris, , 470 p.
- Ursula Klein, « E.F. Geoffroy's table of different 'rapports' observed between different chemical substances - a reinterpretation », Ambix, vol. 42, no Part 2,
- Pierre Joseph Macquer, Dictionnaire de Chymie, Chez Lacombe, (lire en ligne)
- Arthur Donovan, « Lavoisier and the Origins of Modern Chemistry », Osiris, vol. 4, , p. 214-231
- Thomas Kuhn, La structure des révolutions scientifiques, Flammarion,
- Étienne-François Geoffroy, « Eclaircissements: Sur la production artificielle du Fer & sur la composition des autres Métaux », dans Coll., Histoire de l'Académie royale des sciences, Année MDCCVII (1707), Paris, chez Gabriel Martin, Jean Baptiste Coignard & Hippolyte-Louis Guerin, (lire en ligne), p. 176
- M. Goupil, Du flou au clair ? Histoire de l'affinité chimique de Cardan à Prigogine, Comité des travaux historiques et scientifiques - CTHS,
- Rémi Franckowiak, Le développement des théories du sel dans la chimie française de la fin du XVIe à celle du XVIIIe siècle, Atelier national de reproduction des thèses, , 593 p.
- Morveau, Lavoisier, Bertholet & de Fourcroy, Méthode de nomenclature chimique, Cruchet, Paris, (lire en ligne)
- Louis Jacques Bégin, Dictionnaire des termes de médecine, chirurgie, art vétérinaire, pharmacie, histoire naturelle, botanique, physique, chimie, etc, Baillière, (lire en ligne)
- Collectif, Encyclopédie, Dictionnaire raisonné des sciences, des arts et des métiers, par une Société de Gens de lettres, ARTFL Encyclopédie, 1751-1772 (lire en ligne)
- (dir.) Denis Diderot, d'Alembert, Encyclopédie ou Dictionnaire raisonné des sciences, des arts et des métiers, chez Briasson, David, Le Breton, Durand, (tome 13) 1765 (lire en ligne)
- Collectif, Histoire de l'Académie royale des sciences, J. Boudot, Imprimerie royale, Imprimerie Du Pont, Paris, (lire en ligne)
- Joëlle Magnin-Gonze, Histoire de la botanique, Delachaux et Niestlé,
- Nicaise Le Febvre, Cours de chymie, pour servir d'introduction à cette sciences, Vol. 5, Jean-Noel Leloup, Paris, (lire en ligne)
- Nicolas Lémery, Cours de chymie contenant la maniere de faire les operations qui font en usage dans la medecine, par une methode facile, Estienne Michallet, (lire en ligne)
- B. Fosset, J-B. Baudin, F. Lahitète, Chimie tout-en-un, PCSI, Dunod, , 1184 p.
- Nicolas Lémery, Cours de chymie, L.-C. d'Houry, fils (Paris), (lire en ligne)
- Jean-Dominique Bourzat, Lecture contemporaine du Cours de Chymie de Nicolas Lemery, éditions du cosmogone, , 318 p.
- Geoffroy l'Aîné, « Éclaircissements Sur la Table insérée dans les Mémoires de 1718 concernant les Rapports observés entre différentes substances », dans Académie, Histoire de l'Académie royale des sciences, avec les mémoires de mathématique et de physique, Paris, G. Martin, J-B. Coignard fils, L. Guerin, (lire en ligne)
- J-F. Demachy, Recueil de dissertations physico-chymiques, présentées à differentes académies, Monory, (lire en ligne)
- Clausier (traduit et augmenté de beaucoup par), Pharmacopée universelle raisonnée par M. Quincy, d'Houry, Delespine, (lire en ligne)
- Gellert, Ch. E., Chimie métallurgique, dans laquelle on trouvera la théorie & la pratique de cet art (traduit de l'allemand), Briansson,
- Anton Rüdiger, Systematische Anleitung zur reinen und überhaupt applicirten oder allgemeinen Chymie, Dyck,
- Jean-Philippe de Limbourg, Dissertation sur les affinités chymiques, Liège,
- Jacques François Demachy, Précis d'une nouvelle table des combinaisons ou rapports pour servir aux Instituts de chimie, Neuchâtel,
- Lavoisier, « Mémoire sur l'affinité du principe oxygine avec les différentes substances auxquelles il est susceptible de s'unir », dans Lavoisier A., Œuvres de Lavoisier. Tome 2, Paris, Imprimerie impériale, 1862-1893 (lire en ligne)
- Bernadette Bensaude-Vincent, Matière à penser. Essai d'histoire et de philosophie de la chimie, Presse universitaire de Paris Ouest,