TRPV1
Les récepteurs TRPV1 (sigle anglais pour transient receptor potential vanilloide 1) sont des récepteurs ionotropes activés par des molécules de la famille des vanilloïdes (V) telle que la capsaïcine présente dans le piment. Ces récepteurs interviennent dans les mécanismes nociceptifs et s'activent en réponse à un stimulus thermique (Thermosensation) supérieur à 44 °C.
Classification
Les récepteurs TRPV1 font partie de la famille des TRP. Cette famille de récepteurs est sensible aux stimuli mécaniques, thermiques (chaud et froid) et à certaines substances chimiques. Les TRP sont classés en sept groupes : TRPM, TRPA, TRPC, TRPML, TRPN, TRPP et TRPV. Les TRPV étant eux-mêmes répartis en cinq classes (TRPV1,TRPV2, TRPV3, TRPV4, ET TRPV5)[1].
Structure


Les TRPV1 sont des récepteurs de type canaux cations non sélectifs, qui permettent, en réponse à un stimulus, l’entrée des ions Ca2+ (en majorité).
Gradient d'affinité de TRPV1 pour les cations : Ca2+>Mg2+>Na+ >K+ >Cs+. C’est un récepteur membranaire de nature protéique constitué par un enchainement de 839 acides aminés et dont le poids moléculaire est de 94 938 Da. Le gène codant ce récepteur se situe au niveau du segment p 13.2 du chromosome 17 humain. Les TRPV1 sont des tétramères et la région transmembranaire du récepteur est formée par les résidus amino-acyles 433 à 684 qui constituent 6 segments hélicoïdaux transmembranaires (S1-S6). Un petit domaine hydrophobe situé entre les segments S5 et S6 forme le pore du canal, à travers lequel peuvent pénétrer les ions.
Le reste de la protéine, incluant ses extrémités N-ter et C-ter, constitue une large région intra-cytoplasmique qui représente environ 70 % de la masse totale de la protéine.
Des résidus tyrosine (AA n°511) et thréonine (AA n°550) sur le 3e et le 5e domaine transmembranaire sont impliqués dans la liaison du ligand capsaïcine sur le TRPV1.
De plus trois résidus situés à la transition entre la seconde boucle intracellulaire, le 3e domaine transmembranaire (tyrosine:n° 511 et serine: n° 512) ainsi que sur le 5e domaine (tyrosine : n°550) seraient des sites où les agonistes des vanilloides interagiraient avec les TRPV1.
Localisation et mécanisme d'activation
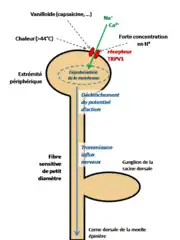
Les TRPV1 sont localisés au niveau de l'extrémité périphérique des neurones sensitifs de petit diamètre. Ce sont des récepteurs sensoriels exprimés au niveau de l'enveloppe cutanée, des muqueuses et dans certaines régions du système nerveux central.
Ils sont activés par une chaleur nociceptive supérieure à 44 °C, un pH bas, ainsi que par les métabolites d’acides linoléiques oxydés (en anglais, oxidized linoleic acid metabolites d'où l'acronyme OLAM) synthétisés lors de brûlures, et de manière générale par d'autres substances appartenant à la famille des vanilloïdes (dont la capsaïcine présente dans le piment).
Lorsque le TRPV1 est soumis à un de ces stimuli, le récepteur est activé et change de conformation ce qui entraîne une ouverture du canal-cation. Les ions Ca++ et Na+ entrent massivement dans le cytoplasme de la fibre nerveuse ce qui crée une dépolarisation. Lorsque la dépolarisation atteint une valeur seuil, elle entraîne le déclenchement d'un potentiel d'action (PA).
Par exemple une faible concentration en H+ ne déclenchera pas de PA, pour cela il faut une acidité suffisamment forte. Celui-ci va alors se propager le long de la fibre sensitive (transmission influx nerveux) pour aller jusqu'au système nerveux central où l'information sera traitée et interprétée comme étant douloureuse.
Activation par des substances exogènes
Au cours de l'évolution, différentes espèces animales et végétales ont acquis la synthèse d'analogues structuraux aux OLAM permettant d'infliger une sensation de brûlure à un adversaire ou prédateur en activant le TRPV1. Ainsi, les différentes variétés de piments produisent des capsaicinoïdes activant le TRPV1. De même, le venin de l'araignée Psalmopoeus cambridgei, originaire de Trinité-et-Tobago, contient des toxines activant le TRPV1[2].
Rôle dans l'inflammation

Lors d’une lésion tissulaire, quelle qu'en soit la nature, une réaction inflammatoire se produit. Cette réaction inflammatoire entraîne une acidose locale, due à une forte libération de H+ dans le milieu. Cet excès de protons ainsi que la bradykinine (polypeptide endogène) et l'ATP, libérés sur le site de l'inflammation, sensibilisent les TRPV1 et provoquent une diminution du seuil d'activation à 34 °C (en milieu neutre, le récepteur ne s'active qu'à partir de 44 °C).
Cette hypersensibilité est également due à la libération sur le site de la lésion du polypeptide NGF (Nerve Growth Factor) par les cellules impliquées dans la réaction inflammatoire.
En effet, le ligand NGF va se fixer sur un récepteur TrkA qui est présent à la surface de l'extrémité périphérique de la fibre sensorielle. Il sera ensuite transporté jusqu'au ganglion de la racine dorsale du neurone (où se situe le noyau cellulaire).
La présence du NGF va entraîner la phosphorylation de la protéine p38 qui ainsi activée va augmenter la traduction de gène codant les récepteurs TRPV1. Le récepteur sera ensuite majoritairement transporté du ganglion vers la périphérie de la fibre sensitive (transport antérograde) pour aller se fixer à la surface de la membrane cytoplasmique où il sera surexprimé (dans un délai de 48h environ après le début de l'inflammation).
Ainsi le nombre de TRPV1 est considérablement augmenté et ceci entraîne une augmentation de la sensibilité à la chaleur qui est caractéristique de la réaction inflammatoire.
Le seuil d'activation des TRPV1 étant plus bas (il peut descendre à 34 °C ) un stimulus thermique non nociceptif peut être perçu comme douloureux, on parle alors d'allodynie.
Implication clinique
La capsaïcine, molécule activatrice des TRPV1 naturellement présente dans le piment, est utilisée dans les traitements thérapeutiques notamment sous forme de crème. Son mode d’action est biphasique : elle engendre d’abord une irritation (brûlure) due à la stimulation de TRPV1. Puis les fibres sensorielles exprimant ce récepteur se désensibilisent. En effet les TRPV1 apparaissent et disparaissent naturellement à la surface membranaire selon un cycle de renouvellement nécessaire à leur fonctionnement. Quand ils sont saturés (stimulés par un excès de capsaïcine) ce recyclage diminue et ils apparaissent de moins en moins à la surface des fibres, provoquant ainsi un effet analgésique.
Dans certains cas, la stimulation de TRPV1 entraîne une augmentation permanente de la concentration intracellulaire en Ca++, ce qui engendre une dégénérescence des fibres portant les TRPV1. Ainsi la douleur est atténuée. La capsaïcine est notamment utilisée dans des crèmes à application locale pour soulager les douleurs arthrosiques, neuropathiques, diabétiques et neurologiques.
Dans le cas d’un diabète sucré, on rencontre fréquemment une complication nerveuse de type neuropathie diabétique périphérique. Cette pathologie entraîne une désensibilisation à la douleur thermique et tactile, ceci serait dû à une modification de l’expression des TRPV1 et TRPA1. SL’insuline et IGF-1, par l’intermédiaire d’un récepteur à l’IGF-1, activeraient l’enzyme PKC impliquée dans l’expression des TRPV1. Ainsi en l'absence d’insuline, il y a diminution de la quantité de trpv1.
Les TRPV1 seraient également impliqués dans l’asthme d’effort, et plus précisément dans le phénomène de bronchoconstriction. Lors de la pratique physique par temps humide et froid, ou par temps sec et chaud, ces variations de température ambiante intra throracique (pulmonaire) aboutissent à l’activation des récepteurs TRPV1 situés sur les fibres C. Pour réguler ces variations de température, et réduire l’effet bronchoconstricteur, le système respiratoire augmente le nombre d’inspiration/expiration par minute, aboutissant à l’hyperventilation.
Les récepteurs TRPV1 pourraient être impliqués dans le mécanisme de l'hyperacousie[3].
Au niveau cardiaque, le cœur présente des fibres afférentes épicardiaques exprimant le récepteur TRPV1 ayant un rôle sur les mécanismes de sympathoexcitation durant l'insuffisance cardiaque[4].
Historique
La protéine a été étudiée et ses rôles mis en évidence par l'équipe de David Julius qui a reçu le Prix Nobel de physiologie et de médecine pour ses travaux concernant les récepteurs à la température.
Sources
- Revue médecine sciences numéro 6-7 p 643 > 766 volume 19 Article p 649-661 sur « l’hypersensibilité à la chaleur au cours de l’inflammation : le rôle du récepteur TRPV1 » de Bernard Calvino (juin-)
- Revue Pour la science n°366 – Article p 54-61 « pourquoi le piment brûle » de Bernard Calvino et Marie Conrath ()
- « 2008 Nature Publishing Group » – Fire in the hole: pore dilation of the capsaicin receptor TRPV1 – Diana Baustia & David Julius (2008)
- Invited review – "Structure and function of TRPV1" – Makoto Tominaga – Tomoko Tominaga
- "Thermosensation and Pain" – Makoto Tominaga, Michael J.Caterina – Section of cell signaling, Okazaki Institute for integrative Bioscience, National Institutes of Natural Sciences, Okazaki 444-8787, Japan
- Séquence des acides aminés de TRPV1 https://www.uniprot.org/uniprot/Q8NER1#section_comments
- Arbre phylogénétique des TRP http://physrev.physiology.org/cgi/content-nw/full/87/1/165/F1
- Carte génétique des TRPV1 https://www.uniprot.org/uniprot/Q8NER1
- TRPV1 Receptors and Signal Transduction - Tamara Rosenbaum1 and Sidney A. Simon21Universidad Nacional Autónoma de México2Duke University https://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=frtrp&part=ch5
- The TRPV1 Receptor: Target of Toxicants and Therapeutics Bellina Veronesi*,1 and Marga Oortgiesen - National Health and Environmental Effects Research Laboratory, U.S. Environmental Protection Agency,Neurotoxicology
- Division–Cellular and Molecular Branch http://toxsci.oxfordjournals.org/cgi/content/full/89/1/1
Notes et références
- Arbre phylogénétique
- Siemens J. et al. (2006) Spider toxins activate the capsaicin receptor to produce inflammatory pain. Nature 444: 208-212.
- Bauer CA, Brozoski TJ, Myers KS. Acoustic injury and TRPV1 expression in the cochlear spiral ganglion. Int Tinnitus J. 2007;13(1):21-8. PubMed .
- (en) Matthew R. Zahner, De-Pei Li, Shao-Rui Chen et Hui-Lin Pan, « Cardiac vanilloid receptor 1-expressing afferent nerves and their role in the cardiogenic sympathetic reflex in rats », The Journal of Physiology, vol. 551, no 2, , p. 515–523 (DOI 10.1113/jphysiol.2003.048207, lire en ligne, consulté le )