Tétrahydropyrane
Le tétrahydropyrane (THP), est un éther cyclique de formule brute C5H10O. C'est le plus simple des oxanes, constitué d'un cycle à six atomes dont un d'oxygène et cinq de carbone. Il s'agit d'un liquide incolore volatil inflammable. On rencontre plus fréquemment ses dérivés, les éthers de tétrahydropyranyle (THP-) étant des intermédiaires courants en synthèse organique par réaction d'alcools sur du dihydropyrane. Le cycle du tétrahydropyrane est notamment présent dans tous les oses en configuration pyranose, par exemple dans le glucopyranose. En phase gazeuse, il se présente en conformation chaise de symétrie Cs[4].
| Tétrahydropyrane | |
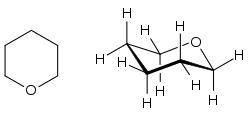
| |
| Structure du tétrahydropyrane | |
| Identification | |
|---|---|
| Nom UICPA | oxane |
| Synonymes |
THP, 2H-tétrahydropyrane, oxacyclohexane, oxyde de pentaméthylène |
| No CAS | |
| No ECHA | 100.005.048 |
| No CE | 205-552-8 |
| DrugBank | DB02412 |
| PubChem | 8894 |
| ChEBI | 46941 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H10O [Isomères] |
| Masse molaire[1] | 86,132 3 ± 0,005 g/mol C 69,72 %, H 11,7 %, O 18,58 %, |
| Propriétés physiques | |
| T° fusion | −49,2 °C[2] |
| T° ébullition | 88 °C[2] |
| Solubilité | 80 g·L-1[2] à 20 °C |
| Masse volumique | 0,88 g·cm-3[2] à 20 °C |
| Point d’éclair | −20 °C[2] ; −16 °C[3] |
| Pression de vapeur saturante | 9,53 kPa[2] à 25 °C |
| Précautions | |
| SGH[2] - [3] | |
  Danger |
|
| Transport[2] - [3] | |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
L'hydrogénation du dihydropyrane au nickel de Raney est un mode de synthèse organique classique du tétrahydropyrane[5].
Utilisation
Le groupe 2-tétrahydropyranyle est utilisé comme groupe protecteur de groupes alcool lors de synthèses organiques[6] - [7]. La réaction d'un alcool avec le dihydropyrane forme un cétal, un α-éther de tétrahydropyranyle, qui protège le groupe alcool d'un grand nombre de réactions :
 Éther de THP.
Éther de THP.
L'alcool peut être rétabli ultérieurement par hydrolyse acide avec formation de 5-hydroxypentanal.
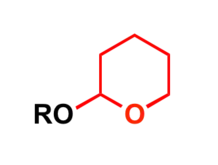 Groupe protecteur au THP en synthèse organique.
Groupe protecteur au THP en synthèse organique.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8 juillet 2016 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Tétrahydropyrane anhydre, 99 %, consultée le 31 mars 2022.
- (en) J. D. Builth-Williams, S. M. Bellm, L. Chiari, P. A. Thorn, D. B. Jones, H. Chaluvadi, D. H. Madison, C. G. Ning, B. Lohmann, G. B. da Silva et M. J. Brunger, « A dynamical (e,2e) investigation of the structurally related cyclic ethers tetrahydrofuran, tetrahydropyran, and 1,4-dioxane », Journal of Chemical Physics, vol. 139, no 3, , p. 034306 (PMID 23883026, DOI 10.1063/1.4813237, lire en ligne)
- (en) D. W. Andrus, John R. Johnson, Nathan L. Drake et Charles M. Eaker, « Tetrahydropyran », Organic Syntheses, vol. 23, , p. 90 (DOI 10.15227/orgsyn.023.0090, lire en ligne)
- (en) R. A. Earl, L. B. Townsend, G. Saucy et G. Weber, « Methyl 4-hydroxy-2-butynoate », Organic Syntheses, vol. 60, , p. 81 (DOI 10.15227/orgsyn.060.0081, lire en ligne)
- (en) Arthur F. Kluge, A. Pilli, Kenneth S. Kirshenbaum, Clayton H. Heathcock et K. Barry Sharpless, « Diethyl[(2-tetrahydropyranyloxy)methyl]phosphonate », Organic Syntheses, vol. 64, , p. 80 (DOI 10.15227/orgsyn.064.0080, lire en ligne)
