Souris à pattes blanches
Peromyscus leucopus

La souris à pattes blanches (Peromyscus leucopus) est un petit rongeur granivore d'Amérique du Nord.
Comme tous les rongeurs, cette souris peut être parasitée (jusqu'à 270 tiques trouvées sur une seule souris). On a montré (en laboratoire, par des inoculations expérimentales[1] et dans la nature) dans les années 1980-1990 qu'elle est un réservoir pour la bactérie responsable de la maladie de Lyme en forte extension aux États-Unis[2] - [3] - [4] - [5]. Elle est soupçonnée de jouer un rôle majeur dans l'extension de l'épidémie de Maladie de Lyme en tant que porteur sain[6] et pourrait être impliquée dans la diffusion d'autres maladies graves.
Description

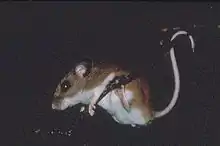
L'adulte mesure entre 15 et 20,5 cm pour un poids allant de 15 à 25 g. Sa queue mesure de 6,5 à 9,5 cm[7].
La durée de vie maximale serait de 96 mois , 8 ans environ, mais l'espérance de vie moyenne des individus de cette espèce est de 45,5 mois pour les femelles et 47,5 pour les mâles, 4 ans environ. Dans les climats nordiques et en présence de prédateurs naturels plus abondants, l'espérance de vie moyenne est de 12 à 24 mois[8].
On la confond souvent avec la souris sylvestre, Peromyscus maniculatus qui lui ressemble à plusieurs égards.
Répartition et habitat
Ce petit rongeur est présent dans les forêts et boisés, parfois très abondant de l'Ontario, au Québec, au Labrador et dans les provinces maritimes (à l'exception de Terre-Neuve) au nord, ainsi que dans le sud-ouest des États-Unis et jusqu'au Mexique[9].
Rôle écoépidémiologique ?
Cette souris est soupçonnée de jouer un rôle majeur d'espèce-réservoir de certains pathogènes pouvant toucher l'Homme et divers animaux domestiques.
Elle pourrait notamment être impliquée dans la diffusion de maladies graves, telles que ;
- Hantaviroses (dues à des hantavirus)
- maladies à tiques dont :
- borrélioses dues à une infection par l'un des variants ou membres de la famille des bactéries spirochètes proche de Borrelia burgdorferi qui causent plusieurs variantes la maladie de Lyme,
- anaplasmoses dues à Anaplasma phagocytophilum
- babésioses induites par le protozoaire Babesia microti).
Peut être à cause du réchauffement climatique, son aire de répartition semble se modifier et remonter vers le nord au détriment de la souris sylvestre (Peromyscus maniculatus),, ce qui pourrait amener de nouvelles maladies zoonotiques au Canada (L'espèce est déjà commune dans le sud du Québec, au sud du Saint-Laurent principalement et tend à remonter vers le nord ; des analyses génétiques permettront de suivre et comprendre son évolution au Canada[10])
Souris à pattes blanches, hôte majeur des spirochètes causant la maladie de Lyme
Au milieu des années 1980, dans la zone côtière du Massachusetts une étude[2] montre que toutes les souris à pattes blanches piégées étaient porteuses de la maladie de Lyme. Or, très abondantes, elles sont aussi l'hôte sur lesquels la nymphe et larve de la tique vectrice Ixodes dammini se nourrit le plus fréquemment (la plupart des tiques immatures I. dammini semblent s'attacher à des souris à pattes blanches). Les auteurs en concluent que la souris à pattes blanches est dans cette région un réservoir essentiel des spirochètes responsables de la maladie de Lyme. D'autres études montreront qu'en Amérique du Nord, cette souris semble être ou est récemment devenue l'un des principaux « réservoirs », de Borrelia burgdorferi parasite spirochète responsable de la maladie de Lyme. Cette bactérie leur est transmise par les tique Ixodes scapularis et Ixodes dammini, notamment dans les forêts écologiquement fragmentées par les routes[3] - [11] (le réchauffement climatique[12] et le degré de fragmentation semble même expliquer les variations introforestières de risque du risque infectieux pour la maladie de Lyme [13]).
Le morcellement des paysages module la densité en tiques, en hôtes mammifères et la composition des cortèges d'espèces. En Amérique du Nord, ce morcellement favorise la souris à pattes blanches, car plus le paysage est fragmenté par des routes, moins les prédateurs (par exemple les loups, lynx, coyotes, renards et rapaces) de cette souris sont présents comment l'on d'abord noté Levi et al. (2012) avec la rareté du Coyote et du renardf se montrant selon eux de solides prédicteurs des cas de maladie de Lyme dans l'est de l'Amérique du Nord, plus que la densité de cervidés [14]. A titre d'exemple, on a évalué que les coyotes du Parc national de Yellowstone consommaient annuellement 76,2% de la biomasse de rongeurs du genre microtus disponible (= 32,4 % de leur alimentation globale)[15] - [16]
En l'absence de prédateurs, les souris les plus infectées et les plus parasitées pourraient survivre plus facilement. Dans les années 1980, des chercheurs ont montré une corrélation entre l'abondance de ces souris et l'abondance de tiques infectées par les borrélies[3]. Le nombre de tique infectées augmente dans les zones boisées les plus fragmentées[11], mais sur la base de relevés faits dans une trentaine de sites entourant la banlieue de la ville de Lyme, selon Brownstein & al. (2005), « malgré ce risque entomologique plus élevé, l'incidence humaine de la maladie de Lyme est plus faible dans des contextes fragmentés, ce qui suggère que le risque entomologique n'est pas le moteur critique des infections humaines (...) Une compréhension complète de l'influence de la fragmentation du paysage permettra d'améliorer la cartographie des risques et la gestion environnementale potentielle de la maladie de Lyme » (rem : un possible biais est que les habitants de Lyme soient plus informés et devenus plus prudents que la moyenne).
Dans son habitats cette souris coexiste avec des cervidés qui semblent être l'hôte préféré des tiques adultes Ixodes dammini. Ces cervidés peuvent être infectés par des tiques préalablement infectées (à l'état de larves) par des souris. Les patterns de prévalence du spirochète relevés dans les forêts de Long Island suggèrent que les cerfs et les souris jouent (au moins dans cette région) conjointement un rôle de réservoirs[17].
Des souris à pattes blanches ont été expérimentalement infectés en laboratoire par Borrelia burgdorferi , par inoculation intrapéritonéale ou sous-cutanée ou par morsure de tique. Le taux de bactérie spirochètes a ensuite été mesuré dans la vessie, la rate, les reins, le sang et l'urine de ces souris[18]. C'est dans les tissus de la vessie (mais jamais dans l'urine) que les spirochètes ont été le plus densément trouvés (94 %), suivi par le rein (75 %), la rate (61 %), et le sang (13 %). En 1988 on ne disposait pas encore de test pour détecter les borrélies, mais il a été confirmé que la mise en culture de tissus de vessie prélevés sur cette souris est très efficace pour isoler B. burgdorferi et que la culture de cet organe peut être utile pour des recherches de spirochètes chez les rongeurs sauvages[18].
Des variations spatiotemporelles de risques ont aussi été reliées aux glandaies. Or cette souris se nourrit notamment de glands et les glandaies favorisent provisoirement leur dynamique de population[19] - [20].
Effets (paradoxaux ?) de la maladie de Lyme sur la souris à patte blanches
Les souris semblent affectées (arthrites) par la co-infection Borrelia + Babesia[21], mais des souris à pattes blanches expérimentalement infectées (par piqure de tique, de manière à mimer au mieux l'infection naturelle) produisent des anticorps contre B. burgdorferi, sans taux plus élevé de globules blancs (par rapport aux souris non infectées)[6]. Elles ne semblent en outre pas affaiblies (Cf. test de la course dans une roue). L'infection par le spirochète B. burgdorferi aurait donc peu d'impact sur la santé de la souris à pattes blanches[6] (elle pourrait donc être porteur sain).
Une étude du Cary Institute of Ecosystem Studies de Millbrook (New York) a fait récemment le point sur 16 ans de suivi de souris infestées par des tiques en s'intéressant à l'impact des tiques sur la santé et la survie des souris, à partir de 5.587 historiques de capture de souris à pattes blanches faites de 1995 à 2011. L'étude a conclu que cette espèce de souris tolère remarquablement bien les tiques, qui pourtant sont parfois nombreuses à les infester (jusqu'à 270 tiques). Les souris parasitées survivent paradoxalement aussi longtemps que les autres, peut-être parce que c'est au stade larvaire que les tiques recherchent ces souris, en ne prélevant alors que très peu de sang. Il se pourrait même que la tique ait développé une relation symbiotique avec la souris à patte blanche car les mâles fortement parasités survivent mieux que ceux qui ne le sont pas. Parmi les hypothèses explicatives avancées figure l'idée que les souris infestées de tiques pourraient adopter un comportement qui les protégerait mieux de la prédation (elles prendraient moins de risques). Il pourrait aussi y avoir un biais d'interprétation : il y aurait simplement moins de prédateurs (et donc moins de risque de prédation) dans les zones plus infestées, ou ce surparasitage indiquerait que les souris vivent dans des zones plus favorables à la fois aux souris et aux tiques (ex : microhabitats plus enherbés où les souris peuvent mieux se cacher de leurs prédateurs). La taille de l'animal a aussi été évoquée : les souris plus grosses tout en étant plus parasitées auraient néanmoins plus de chances de survie.
On sait que de manière générale et théorique, une réaction immunitaire dirigée vers un parasite vecteur de pathogènes peut dans certains cas fortement diminuer le risque écoépidémiologique (par exemple un lapin souvent piqué par des tiques non-infectées y devient hypersensible (allergique), mais a ensuite moins de chance d'être victime d'une tularémie[22].
Des chercheurs se sont demandé si la souris pouvait s'immuniser contre les piqures de tiques Ixodes ou contre leurs effets. Ils ont pour cela comparé l'infectivité de borrélies inoculées par des tiques à des souris à pattes blanches (et à des souris de laboratoire) préalablement infestées à plusieurs reprises par des tiques non infectées). Les résultats ont montré que les nymphes de tiques se gorgent facilement de sang sur des souris préalablement exposées à des tiques non infectées, mais avec un succès d'alimentation qui a progressivement diminué. Cependant cette légère immunisation n'a pas empêché la transmission des spirochètes inoculées par des tiques infectées à des souris préalablement exposées à des tiques non infectées[23].
Virus
Comme une autre souris (Peromyscus maniculatus) qui lui ressemble, cette espèce joue aussi un rôle de «réservoir» d'hantavirus, virus qui cause des maladies graves à mortelles chez l'homme[24].
La fragmentation des forêts par l'Homme favorise en Amérique du Nord cette espèce. Les scientifiques constatent que plus la forêt est fragmentée par des routes, moins les prédateurs des micromammifères sont présents, plus les hommes (chasseurs notamment) pénètrent facilement la forêt et plus ces souris sont nombreuses ; et plus elles sont nombreuses à être infectées par des borrélies ; et plus les tiques portées par les souris sont également nombreuses et plus fréquemment infectées[3], ce qui favorise la diffusion de l'épidémie.
La reforestation (forêts dites « de transition »), quand elle se fait dans les conditions évoquées ci-dessus (artificielle, avec fragmentation des forêts et absence de grands prédateurs ou pullulation de micromammifères ou de gibier) semble parfois pouvoir favoriser certaines zoonoses, dont la maladie de Lyme[25].
Voir aussi
Articles connexes
Références taxonomiques
- (en) Référence Mammal Species of the World (3e éd., 2005) : Peromyscus leucopus
- (fr+en) Référence ITIS : Peromyscus leucopus (Rafinesque, 1818)
- (en) Référence Animal Diversity Web : Peromyscus leucopus
- (en) Référence NCBI : Peromyscus leucopus (taxons inclus)
- (en) Référence UICN : espèce Peromyscus leucopus (Rafinesque, 1818) (consulté le )
Liens externes
- White-footed Mouse ; Peromyscus leucopus (Fairfax County Public Schools, Fairfax County, Virginie) (en)
- La maladie de Lyme progresse avec les souris à pattes blanches ;
Notes et références
- K.D. Moody, G.A. Terwilliger, G.M. Hansen et S.W. Barthold, « Experimental Borrelia burgdorferi infection in Peromyscus leucopus », J Wildl Dis, vol. 30, , p. 155–161 (lire en ligne [PDF])
- J.F. Levine, M.L. Wilson et A. Spielman A, « Mice as reservoirs of the Lyme disease spirochete », Am J Trop Med Hyg, vol. 34, , p. 355–360 (PMID 3985277, résumé)
- J.G.Donahue, J. Piesman et A. Spielman, « Reservoir competence of white-footed mice for Lyme disease spirochetes », Am J Trop Med Hyg, vol. 36, , p. 92–96 (PMID 3812887, résumé)
- L.R. Lindsay, I.K. Barker, G.A. Surgeoner, S.A. McEwan et G. Douglas Campbell, « Duration of Borrelia burgdorferi infectivity in white-footed mice for the tick vectors Ixodes scapularis under laboratory and field conditions in Ontario », J Wildl Dis, vol. 33, , p. 766–775 (lire en ligne [PDF])
- R.S. Lane, J. Piesman, W. Burgdorfer, « Lyme borreliosis: relation of its causative agent to its vectors and hosts in North America and Europe », Ann Rev Entomol, vol. 36, , p. 587–609
- L.E. Schwanz, M.J. Voordouw, D. Brisson et R.S. Ostfeld, « Borrelia burgdorferi has minimal impact on the Lyme disease reservoir host Peromyscus leucopus », Vector-borne and zoonotic diseases, vol. 11, no 2, , p. 117-124 (lire en ligne [PDF])
- (en) Référence Animal Diversity Web : Peromyscus leucopus
- Mammalian Models for Research on Aging, , 587 p. (ISBN 978-0-309-03094-6, présentation en ligne)
- Linzey, A.V., Matson, J. & Timm, R. (2008). « Peromyscus leucopus ». IUCN Red List of Threatened Species. Version 2009.2. International Union for Conservation of Nature. Retrieved 05 February 2010.
- La maladie de Lyme progresse avec les souris à pattes blanches ; 5 décembre 2011 .
- Allan, B. F., Keesing, F., & Ostfeld, R. S. (2003). Effect of forest fragmentation on Lyme disease risk. Conservation Biology, 17(1), 267-272.
- Tran, P. M., & Waller, L. (2013). Effects of landscape fragmentation and climate on Lyme disease incidence in the northeastern United States. Ecohealth, 10(4), 394-404 (résumé).
- Brownstein, J. S., Skelly, D. K., Holford, T. R., & Fish, D. (2005). Forest fragmentation predicts local scale heterogeneity of Lyme disease risk. Oecologia, 146(3), 469-475.
- Way, J. G., & White, B. N. (2013). Coyotes, red foxes, and the prevalence of Lyme disease. Northeastern Naturalist, 20(4), 655-665.
- Crabtree, R.L., and J.D. Varley (1995) The ecological and sociod"emographic role of the Coyote on Yellowstone’s Northern Range. Pp. 63–84, In A.P. Curlee, A.M. Gillesburg, and D. Casey (Eds.). Proceedings of the 3rd biennial science conference on the Greater Yellowstone Ecosystem, Greater Yellowstone’s Predators. Yellowstone National Park and Northern Rockies Conservation Cooperative, Mammoth, WY.
- Crabtree, R.L., and J.W. Sheldon. (1999) The ecological role of Coyotes on Yellowstone’s Northern Range. Yellowstone Science 7:15–24.
- E.M. Bosler, B.G. Ormiston, J.L. Coleman, J.P. Hanrahan et J.L. Benach, « Prevalence of the Lyme disease spirochete in populations of white-tailed deer and white-footed mice », Yale J Biol Med., vol. 57, no 4, , p. 651-659 (lire en ligne [PDF])
- T.G. Schwan, W. Burgdorfer, M.E. Schrumpf et R.H. Karstens, « The urinary bladder, a consistent source of Borrelia burgdorferi in experimentally infected white-footed mice (Peromyscus leucopus) », J Clin Microbiol, vol. 26, , p. 893–895 (lire en ligne [PDF])
- C.G. Jones, R.S. Ostfeld, M.P. Richard, E.M. Schauber et J.O. Wolff, « Chain reactions linking acorns to gypsy moth outbreaks and Lyme disease risk », Science, vol. 279, , p. 1023–1026 (lire en ligne [PDF])
- R.S. Ostfeld, C.D. Canham, K. Oggenfuss, R.J. Winchcombe RJ et F. Keesing, « Climate, deer, rodents, and acorns as determinants of variation in Lyme-disease risk », PLoS Biol, 2006; 4:e145 (DOI 10.1371/journal.pbio.0040145)
- M.H. Moro, O.L. Zegarra-Moro, J. Bjornsson, E.K. Hofmeister, et al., « Increased arthritis severity in mice coninfected with Borrelia burgdorferi and Babesia microti », J Infect Dis, vol. 186, , p. 428–431 (lire en ligne [PDF])
- J.F. Bell, S.J. Stewart et S.K. Wikel, « Resistance to tick-borne Francisella tularensis by tick-sensitized rabbits: allergic klendusity », Am. J. Trop. Med. Hyg., vol. 28, , p. 876–880 (résumé)
- D. Richter, A. Spielman et F.R. Matuschka FR, « Effect of prior exposure to noninfected ticks on susceptibility of mice to Lyme disease spirochètes », Applied and environmental microbiology, vol. 64, no 11, , p. 4596-4599 (lire en ligne)
- Hantavirus Pulmonary Syndrome — United States: Updated Recommendations for Risk Reduction, Voir p. 65 [PDF]
- Z. Popoviće et S. Popović, « Forest Transition and Zoonoses Risk », Encyclopedia of Environmental Health, , p. 803–811 (résumé)
Bibliographie
- Anderson JF, Johnson RC, Magnarelli LA (1987) Seasonal prevalence of Borrelia burgdorferi in natural populations of white-footed mice, Peromyscus leucopus. J Clin Microbiol ; 25:1564–1566
- Anita Rogic, Nathalie Tessier, Pierre Legendre, François-Joseph Lapointe, Virginie Millien (2013) Genetic structure of the white-footed mouse in the context of the emergence of Lyme disease in southern Québec. Ecology and Evolution 3:7, 2075-2088, mis en ligne (résumé)
- Barthold, SW, Persing, DH, Armstrong, AL, Peeples, RA. (1991) Kinetics of Borrelia burgdorferi dissemination and evolution of disease after intradermal inoculation of mice. Am J Pathol ; 139:263–273
- Bunikis J, Tsao J, Luke CJ, Luna MG & al. (2004) Borrelia burgdorferi infection in a natural population of Peromyscus leucopus mice: a longitudinal study in an area where Lyme borreliosis is highly endemic. J Infect Dis ; 189:1515–1523
- Brunner JL, LoGiudice K & Ostfeld RS (2008) Estimating reservoir competence of Borrelia burgdorferi hosts: prevalence and infectivity, sensitivity, and specificity. J Med Entomol ; 45:139–147
- Burgess EC, French JrJB & Gendron-Fitzpatrick A. (1990) Systemic disease in Peromyscus leucopus associated with Borrelia burgdorferi infection. Am J Trop Med Hyg ; 42:254–259
- Goodwin BJ, Ostfeld RS & Schauber EM (2001) Spatiotemporal variation in a Lyme disease host and vector: black-legged ticks on white-footed mice. Vector Borne and Zoonotic Diseases, 1(2), 129-138.
- Hofmeister EK, Ellis BA, Glass GE & Childs JE (1999) Longitudinal study of infection with Borrelia burgdorferi in a population of Peromyscus leucopus at a Lyme disease-enzootic site in Maryland. Am J Trop Med Hyg ; 60:598–609
- Horka H, Cerna-kyckovaa K, Kallova A & Kopecky J (2009) Tick saliva affects both proliferation and distribution of Borrelia burgdoferi spirochetes in mouse organs an increases transmission of spirochetes by ticks. Int J Med Microbiol ; 299:373–380
- Martin LB, Weil ZM, Kuhlman JR & Nelson RJ (2006) Trade-offs within the immune systems of female white-footed mice, Peromyscus leucopus. Funct Ecol ; 20:630–636.
- Martin LB, Weil ZM & Nelson RJ (2007) Immune defense and reproductive pace of life in Peromyscus mice. Ecology ; 88:2516–2528
- Ostfeld RS, Miller MC & Hazler KR (1996) Causes and consequences of tick (Ixodes scapularis) burdens on white-footed mice (Peromyscus leucopus). J Mammal ; 77:266–273.
- Ostfeld RS, Schauber EM, Canham CD, Keesing F & al. (2001) Effects of acorn production and mouse abundance on abundance and Borrelia burgdorferi infection prevalence of nymphal Ixodes scapularis ticks. Vector Borne Zoonot Dis ; 1:55–63
- Pederson AB, Grieves TJ (2008) The interaction of parasites and resource cause crashes in wild mouse population. J Anim Ecol ; 77:370–377
- Schwan, TG, Burgdorfer, W, Schrumpf, ME, Karstens, RH. (1988) The urinary bladder, a consistent source of Borrelia burgdorferi in experimentally infected white-footed mice ( Peromyscus leucopus). J Clin Microbiol ; 26:893–895 (PDF, 4 pp).
- Schwan TG, Kime KK, Schrumpf ME, Coe JE et al (1989) Antibody response in white-footed mice (Peromyscus leucopus ) experimental infected with the Lyme disease spirochete (Borrelia burgdorferi). Infect Immunol ; 57:3445–3451
- Schwanz LE, Voordouw MJ, Brisson D& Ostfeld RS (2011) Borrelia burgdorferi has minimal impact on the Lyme disease reservoir host Peromyscus leucopus ; Vector-borne and zoonotic diseases, 11(2), 117-124
