Rouille (maladie)
Les rouilles sont un ensemble de maladies cryptogamiques des plantes vasculaires dont les agents pathogènes responsables sont des champignons basidiomycètes (Fungi) de l'ordre des Pucciniales (anciennement Uredinales) et plus largement appartenant à la sous-division des Pucciniomycotina.

.jpg.webp)
Ces champignons phytopathogènes sont des parasites obligatoires biotrophes, ne pouvant se développer que sur un végétal vivant, et dont les espèces sont hautement spécialisées. Elles se manifestent par des taches ou des pustules apparaissant sur les feuilles. Le cycle de vie de ces champignons est complexe : lorsqu'il est complet, il caractérisé par l’émission temporaire et successive de cinq types de spores naissant dans des structures différentes sur des organes annuels comme les feuilles et les tiges, plus rarement sur des organes vivaces comme les troncs ou les racines. Il est également caractérisé par des changements d'hôte souvent très éloignées les uns des autres du point de vue de la parenté, comme par exemple les graminées et les arbres.
Les champignons de la rouille sont très répandus et se rencontrent régulièrement. Ils sont surtout visibles en été et en automne dans leur stade télie où ils sont plus faciles à identifier car tous les stades ne s'y prêtent pas. Afin de déterminer l'espèce et le stade de développement, il est souvent indispensable d'utiliser un microscope afin d'étudier les spores. En effet, la classification des champignons de la rouille se base sur leur forme, leur couleur, leur taille et leur ornementation ainsi que la présence ou l'absence de papilles, de pores germinatifs ou de pédoncules. De plus, certaines espèces comme le genre Melampsora forment des éléments stériles dans les spores, appelés paraphyses, dont la forme, la taille et l'épaisseur de la paroi sont également importantes pour la détermination[1].
Parmi les espèces communes en Europe occidentale se trouvent par exemple Coleosporium tussilaginis dont l'hôte principal est le Tussilage et l'hôte secondaire un Pin ; Puccinia lagenophorae sur la pâquerette sans qu'il y ait de changement d'hôte ; Puccinia malvacearum sur la Mauve alcée sans qu'il y ait de changement d'hôte, Puccinia poarum sur le Tussilage comme hôte principal et les graminées du genre Poa comme hôtes intermédiaires et Puccinia taraxaci sur le Pissenlit sans qu'il y ait non plus d'hôte intermédiaire[1].
Par analogie, certaines maladies dues au genre Albugo, un Oomycètes, sont appelées rouille blanche comme la rouille blanche des crucifères et la rouille blanche de la patate douce. Cependant, elles correspondent à des symptômes différents et à un cycle de vie différent des rouilles dues aux Pucciniales.
Histoire

Les rouilles affectent l'agriculture depuis que l'homme a commencé à tenter de dompter les plantes pour les cultiver, en particulier les céréales telles que le blé et l'orge[2].
Des preuves archéologiques montrent que les cultures de céréales galloromaines étaient constamment touchées par des rouilles et mildious.
Au IVe siècle, les Romains sacrifiaient des bovins roux, des renards et des chiens au dieu Robigus en espérant qu'il éloigne les épidémies de rouilles de céréale des cultures[2].
Ces pathogènes fongiques sont mieux connus et l'on commence à comprendre comment ils peuvent contourner le système immunitaire de la plante via la sécrétion de petites protéines dites « effectrices ». On espère que mieux connaitre ces effecteurs et leurs mécanismes permettra de mieux anticiper la propagation mondiale des rouilles du blé[2] et leur adaptation aux pesticides.
Cycle de vie des champignons de la rouille
Le cycle de vie des espèces de champignons agents des rouilles est unique dans le règne fongique. En effet, le développement complet d'une seule espèce comprend souvent jusqu'à cinq stades différents, désignés par des chiffres romains. Cependant certaines espèces raccourcissent leur cycle de développement en supprimant quelques stades. Une autre particularité est le changement d'hôtes qu'effectuent certaines espèces. Les spermogonies et les écidies sont des stades haploïdes formés sur l'hôte intermédiaire et les urédies et les télies sont des stades diploïdes formés sur l'hôte principal. Le changement se fait alors entre des plantes qui sont souvent très éloignées les unes des autres du point de vue de la parenté, comme par exemple les graminées et les arbres. Le changement d'hôte permet en outre aux champignons de la rouille de coloniser des habitats écologiques totalement différents à l'instar d'une prairie et d'une forêt[1] - [3].
Spermogonie
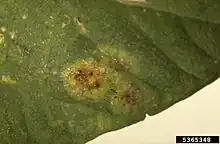
Les spermogonies (0) sont généralement rondes, coniques ou en forme de pustule, de couleur jaune, orange ou foncée, se trouvent régulièrement sur le dessus des feuilles et dégagent souvent des odeurs particulière comme spermatique, douceâtre, moisie, , etc.[1] - [3].
Écidie

Les écidies (I), qui sont un stade asexué, ont différentes morphologies : type Aecidium, type Caeoma, type Peridermium et type Roestelia. Le type Aecidium est le plus commun ; ses écidies se présentent sous la forme de gobelet ou de tonneau, de couleur jaune orangé, plus rarement blanche. Cette forme est due à une enveloppe protectrice, plus précisément un pseudo-péridium, qui peut être réfléchie à son extrémité et qui est souvent effilochée. Ces structures sont formées sur les organes végétaux les plus divers et peuvent y provoquer des galeries ou des déformations massives. Le type Caeoma qui se retrouve dans le genre Melamspora, est dépourvu de cette marge et n'est protégé que par les tissus de l'hôte. C'est pourquoi ses structures sont en forme de pustule. Il est généralement jaune ou orange. Dans le type Peridermium des genres Coleosporium et Chrysomyxa, les écidies ont un aspect vésiculeux lorsque le péridium est fermé. Le type Roestelia qui se retrouve dans le genre Gymnosporangium présente des écidies orangé brunâtre en forme de corne due à un long pseudo-péridium[1] - [3].
Urédie
.jpg.webp)
Les urédies (II) sont un stade asexué des champignons de la rouille qui peuvent infecter en très peu de temps de grandes surfaces d'une population d'hôtes. Chez les genres très communs Puccinia et Uromyces, les urédies se développent de part et d'autre des feuilles sur des taches foliaires plus ou moins voyantes et bombées, sous forme de pustules brun-cannelle ou brun-rouille, qui se couvrent précocement. Elles sont également disposées en anneau. Mais elles peuvent aussi être jaunâtres à orange vif sous forme de coussinets comme chez Melamspora et Coleosporium ou sous forme de pustules comme chez Pucciniastrum. Les urédies blanches du genre Milesina, dont les hôtes sont des fougères, constituent une particularité. Certaines espèces comme Triphragmium ulmariae produisent des urédies primaires et secondaires qui diffèrent par leurs caractéristiques macroscopiques et microscopiques[1] - [3].
Télie

Les télies (III), qui constituent un stade sexué du cycle de vie des Pucciniales, sont généralement en forme de sore, de couleur brun noir à brun. Elles sont produites sur les feuilles et les tiges et y provoquent régulièrement des malformations. Mais il existe aussi des formes recouvertes par l'épiderme qui prennent un coloration plomb. Il se trouve également des sores brillantes et croûteuses, rouge foncé comme chez Coleosporium ou orange à brunes comme chez Malanspora. Le genre Cronartium forme des télies étroites, cornées ou filamenteuses, brun foncé ; le genre Gymnosporangium forme des fructifications gélatineuses cornées ou en forme de langue ; le genre Microbotryum, souvent désigné comme faux-charbon, se présente sous forme de masse de spores poussiéreuses noir-violet ou brun clair dans différents organes floraux et plus rarement sur les feuilles et les tiges. En raison de leur aspect charbonneux, il a longtemps été considéré comme un véritables agent du charbon. Les champignons de la rouille hivernent sous forme de téliospores[1] - [3].
Baside
Les basides (IV) germent à partir des téliospores et sont reconnaissables à la couche blanchâtre ressemblant à du givre qu'elles forment sur les télies. C'est sur elles que se forment les basidiospores. Il est rare d'observer sur le terrain la formation de basides[1] - [3].
Vocabulaire
Lorsqu'une espèce effectue un cycle complet comprenant les stades 0, I, II, III, IV, la rouille est dite macrocycle ; lorsque les urédies (II) font défaut, la rouille est dite hémicyclique et lorsque le cycle ne comporte que des serpomogonies (0) et des télies (III) ou uniquement des télies (III), la rouille est dite microcyclique[4].
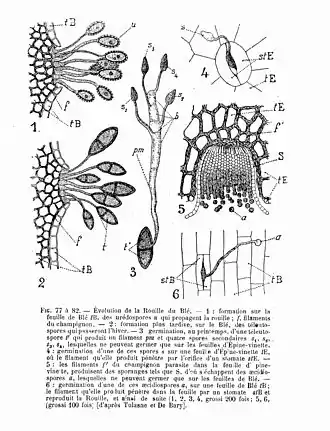
Une rouille est autoxène lorsque son cycle biologique s'accomplit sur la même plante-hôte comme Puccinia menthae sur la Menthe des champs, où les stades 0, I, II, III sont présents. Une rouille est hétéroxène lorsque ses écidies (I) se forment sur une plante d'un genre donné tandis que ses autres stades évolutifs apparaissent obligatoirement sur une seconde plante de genre différent du premier comme Puccinia graminis dont les stades 0 et I se font sur l'Épine-vinette et les stades II et III sur le blé[4].
Cycle de vie type
.png.webp)
Au printemps, la basidiospore (IVsp.) issue de la téliospore (IIIsp.) hivernale germe au contact de l’hôte sur lequel elle est transportée par le vent, la pluie ou les insectes. Après infection, le champignon provoque l’apparition d’une tache foliaire. Un filament mycélien haploïde de valence sexuelle - ou + naît directement de la basidiospore qui produit une spermogonie (0) odorante sur le dessus de la feuille. Ses spermaties (0sp.) s'agglutinent dans une gouttelette de miellat qui recouvre l'ostiole qui la surmonte. Les spermaties sont alors transférées par des insectes attirés par le miellat et l'odeur sur un hyphe récepteur proéminent d'une autre spermogonie qui achemine son noyau jusqu'à une protocécidie de valence sexuelle opposée généralement située de l'autre côté sur la face inférieure de la feuille, ce qui provoque sa fertilisation et la transforme en une écidie véritable (I). C'est le début de la dicaryotisation[4] - [5].
Le développement, toujours printanier, de l'écidie (I) est très rapide. Protégée par son enveloppe protectrice, elle génère des écidiospores (Isp.) qui contiennent deux noyaux haploïdes. Les espèces pratiquant le changement d'hôte le font principalement lors de la dissémination des écidiospores (Isp.)[4] - [5].
Cette écidiospore (Isp.) germe sur la plante et un mycélium se développe rapidement en une urédie (II) qui contient des urédospores (IIsp.). Celles-ci germent directement et généralisent l'infection sur la plante en dispersant la maladie de façon exponentielle[4] - [5].
Des télies (III) estivales et automnales en forme de pustules, de coussinets ou de cornes apparaissent sur le mycélium et produisent des spores particulières : les deux noyaux haploïdes jusqu'ici séparés s'unissent pour donner la téliospore (IIIsp.). Elles sont munies d'un pédicelle hyalin et contiennent une ou plusieurs protobasides. C'est la fin de la dicaryotisation. Ce sont ces spores à la paroi renforcée qui permettent au champignon de passer l'hiver[4] - [5].
Les protobasides de chaque téliospores germent. Se développent un mycélium court et le noyau de la protobaside qui se divise par méïose en quatre noyau haploïdes pour donner une véritable baside (IV). Elle produit une basidiospore (IVsp.) qui n'est pas capable d'infester l'hôte principal mais qui contamine l'hôte secondaire printanier en étant disséminée par le vent, l'eau ou les insectes[4] - [5].
Biologie
Les rouilles sont provoquées par des champignons produisant en abondance des spores de 5 à 10 µm de diamètre en moyenne, de couleur claire, hyalines le plus souvent, jaune orangées, légèrement verdâtres ou brunâtres (couleurs caractéristiques à l’origine de la dénomination de ces maladies), parfois mélanisées à des degrés variables, surtout chez les spores de résistance, la mélanine qui indure leur paroi ayant des propriétés antilytiques qui leur permet de passer la mauvaise saison[6].
La plupart des spores sont éjectées dans l'air (autochorie) dans le but de les éloigner « de la colonie mère et de favoriser la dispersion en traversant la zone calme laminaire (quelques millimètres), qui entoure la surface de tout objet, pour tomber dans la zone turbulente. » Les autres facteurs de dispersion sont la distance ; la déposition : les petites spores sont dispersées par le vent (anémochorie, mode de dispersion le plus fréquent, les spores pouvant parcourir des milliers kilomètres) ou les gouttes de pluie (effet splash caractéristique de l'ombrochorie (de)), les plus grosses tombent par gravitation (barochorie) ; l'impaction (en) ; potentiel d'inoculation (vitesse de la germination, abondance de spores, capacité de surmonter les compétiteurs, etc.) qui dépend des réserves nutritives contenues dans la spore[7]. La dispersion des spores par les graines de plantes est plus fréquente qu'on ne l'imagine[8], de même que celle par l'homme (anthropochorie), agent de propagation de plus en plus efficace[9].
Principaux genres européens
- Chrysomyxa : l'écidie (I) est de type peridermium. Ses écidospores (Isp.), urédospores (IIsp.) et téliospores (IIIsp.) ne sont pas pédonculées et sont formées en chaînes. À l'exception du genre Coleosporium, tous les autres présentent des urédospores (IIsp.) pédonculées. Ce genre présente typiquement un cycle entre les aiguilles ou les cônes de Picea et les Ericaceae. Exemple : Chrysomyxa rhododendri[3].
- Coleosporium : l'écidie (I) est de type peridermium. les urédospores (IIsp.) sont similaires à celle de Chrysomyxa. La télie (III) est située sous l'épiderme et forme des croûtes cireuses rouge vif. Ce genre présente typiquement un cycle entre les aiguilles de Pinus et des angiospermes, surtout des Astéracées. Exemple : Coleosporium asterum[3].
- Cronartium : l'écidie (I) est de type peridermium. L'urédie (II) présente un péridium et la télie (III) forme des colonnes. Ce genre présente typiquement un cycle entre le tronc et les rameaux de Pinus et divers angiospermes. Exemple : Cronartium ribicola[3].
- Gymnosporangium : l'écidie (I) est de type Roestelia. La spermogonie (0) et l'écidie (I) sont remarquables. les écidiospores (Isp.) sont grandes et présentent une paroi épaisse et des pores germinatifs évidents. L'urédie (II) ne se forme pas, à une exception près. La télie (III) est grande, orange vif à rougeâtre, gélatineuse et gonfle à l'humidité. Les téliospores (IIIsp.) présentent un long pétiole et deux cellules. Elles germent immédiatement. Ce genre présente typiquement un cycle entre l'écidie (I) du début de l'été à l'automne sur les feuilles ou fruits des fruitiers à pépins et la télie (III) au printemps sur les troncs, rameaux ou aiguilles de Juniperus. Exemple : Gymnosporangium clavariiforme[3].
- Melampsora : l'écidie (I) est de type Caeoma. L'urédie (II) est orange clair. la télie (III) forme des croûtes sous l'épiderme. Ce genre présente typiquement un cycle entre divers gymnospermes ou angiospermes et des Salicaceae comme les Peupliers ou les Saules. Quelsues espèces sur gymnospermes ne changent pas d'hôte. Exemple : Melampsora euonymi-caprearum[3].
- Melampsoridium : l'écidie (I) est de type péridermium. L'urédie (II) présente un péridium et des pores ouverts. Les urédospres (IIsp.) sont incolores et à pores germinaux. La télie (III) est située sous l'épiderme. Ce genre présente typiquement un cycle entre les aiguilles de Mélèze et les Betulaceae. Exemple : Melampsoridium carpini[3].
- Milesina : l'écidie (I) est de type péridermium. L'urédie (II) présente un péridium. Les urédospores (IIsp.) ont un pédoncule court et une paroi incolore. Les téliospores (IIIsp.) sont sans pédoncule et multicelulaires avec des parois verticales. Ce genre présente typiquement un cycle entre les aiguilles de Sapins Abies et les fougères. Exemple : Milesina dieteliana sur Polypodium[3].
- Phragmidium : l'écidie (I) est de type Caeoma et présente comme l'urédie (II) des paraphyses incolores. Leurs spores (Isp. et IIsp.) sont verruqueuses. La télie (III) est généralement noire et les téliospores (IIIsp.) ont un long pédoncule et sont multicellulaires. Ce genre se développe sur des Rosacées sans effectuer de changement d'hôte. Exemple : Phragmidium mucronatum sur Rosa canina[3].
- Puccinia : l'écidie (I) est de type aecidium. Les urédospores (IIsp.) présentent des pores germinaux. Les téliospores (IIIsp.) sont pédonculées, généralement à 2 cellules, nettement épaissies au sommet et présentent un pore germinatif par cellule. Tous les stades de développement sont répandus sur de nombreux angiospermes. Exemple : Puccinia pulverulenta sur Epilobium hirsutum[3].
- Pucciniastrum : l'écidie (I) est de type péridermium. L'urédie (II) est située au dessus de l'épiderme et présente une péridie. La télie (III) produit des croûtes sous-épidermiques. Les téliospores (IIIsp.) sont serrés les unes contre les autres et présentent deux à plusieurs cellules cloisonnées. Ce genre présente typiquement un cycle entre les aiguilles de sapin et les Onagraceae ou les Ericaceae. Exemple : Pucciniastrum areolatum[3].
- Tranzschelia : l'écidie (I) est de type aecidium. Les urédospores présentent (IIsp.) une paroi lisse épaissie au sommet. Les téliospores (IIIsp.) se présentent par deux et sont semblables à celles de Puccinia, mais se séparent légèrement. Leur paroi est généralement verruqueuse ou épineuse. Ce genre se trouve sur les Renonculacées sur lesquelles il effectue un cycle complet ou change d'hôtes avec les fruitiers à noyau. Exemple : Tranzschelia discolor sur Prunus domestica[3].
- Uromyces : similaire au genre Puccinia, mais produit des téliospores (IIIsp.) à une seule cellule. Exemple : Uromyces ficariae[3].
Traitements
Les moyens de lutte contre les rouilles furent longtemps cantonnés à la tentative d'éradication des hôtes écidiens.
Traitements naturels
Le traitement classique consiste à supprimer puis brûler les feuilles atteintes et à pulvériser préventivement de la bouillie bordelaise ou avec une décoction de prêle, qui est aussi curative et utilisée en potager bio[10] - [11] - [12].
La méthode de lutte en agriculture biologique consiste à planter des cultivars résistants ou, à défaut, d'augmenter la distance entre les rangées de plants et d'orienter celles-ci pour que l'humidité stagnante soit limitée par une exposition judicieuse aux vents dominants[13].
Traitements phytosanitaires
L'arsenal phytopharmaceutique actuel est plus efficace avec les molécules[14]:
- azoxystrobine
- chlorothalonil
- cyproconazole
- cyprodinil
- diclobutrazol
- difénoconazole
- époxiconazole
- fenpropimorphe
- fluquinconazole
- flusilazole
- flutriafol
- krésoxim-méthyl
- mancozèbe
- manèbe
- metconazole
- oxycarboxine
- picoxystrobine
- propiconazole
- propinèbe
- pyraclostrobine
- quinoxyfène
- spiroxamine
- tébuconazole
- tétraconazole
- triadiméfon
- triadiménol
- tridémorphe
- trifloxystrobine
Note: Certains de ces produits ne sont plus autorisés à la vente en Europe, et ne peuvent l'être que sur certaines espèces cultivées.
Liste des maladies appelées « rouilles » en français
| Nom de la maladie | Agent pathogène | code OEPP |
|---|---|---|
| fausse rouille du mûrier | Mycosphaerella mori | MYCOMO |
| rouille américaine du groseillier | Endocronartium pini | ENDCPI |
| rouille américaine du soja | Phakopsora meibomiae | PHAKME |
| rouille asiatique du groseillier | Cronartium ribicola | CRONRI |
| rouille asiatique du soja | Phakopsora pachyrhizi | PHAKPA |
| rouille blanche de la patate douce | Albugo ipomoeae-panduratae | ALBUIP |
| rouille blanche de la scorsonère | Albugo tragopogonis | ALBUTR |
| rouille blanche de l'épinard | Albugo occidentalis | ALBUOC |
| rouille blanche des composées | Albugo tragopogonis | ALBUTR |
| rouille blanche des crucifères | Albugo candida | ALBUCA |
| rouille blanche du chrysanthème | Puccinia horiana | PUCCHN |
| rouille blanche du salsifis | Albugo tragopogonis | ALBUTR |
| rouille blanche du tournesol | Albugo tragopogonis | ALBUTR |
| rouille brune | Puccinia recondita | PUCCRE |
| rouille brune de l'orge | Puccinia hordei | PUCCHD |
| rouille brune du blé | Puccinia triticina | PUCCRT |
| rouille brune du chrysanthème | Puccinia chrysanthemi | PUCCCH |
| rouille brune du haricot | Uromyces appendiculatus | UROMAP |
| rouille brune du seigle | Puccinia recondita f. sp. recondita | PUCCRR |
| rouille commune de la pomme de terre | Puccinia pittieriana | PUCCPT |
| rouille commune du chrysanthème | Puccinia chrysanthemi | PUCCCH |
| rouille commune du trèfle | Uromyces trifolii | UROMTR |
| rouille courbeuse des rameaux du pin | Melampsora pinitorqua | MELMPP |
| rouille couronnée de la bourdaine | Puccinia coronata f. sp. calamagrostidis | PUCCCM |
| rouille couronnée de la fétuque | Puccinia coronata f. sp. festucae | PUCCCF |
| rouille couronnée de l'agrostide | Puccinia coronata f. sp. agrostidis | PUCCCG |
| rouille couronnée de l'avoine | Puccinia coronata | PUCCCO |
| rouille couronnée de l'avoine | Puccinia coronata f. sp. avenae | PUCCCA |
| rouille couronnée des graminées | Puccinia coronata | PUCCCO |
| rouille couronnée du ray-grass | Puccinia coronata f. sp. lolii | PUCCCL |
| rouille couronnée du vulpin | Puccinia coronata f. sp. alopecuri | PUCCCC |
| rouille crustacée du framboisier | Pucciniastrum americanum | PUCIAM |
| rouille de la betterave | Uromyces betae | UROMBE |
| rouille de la bruyère | Thekopsora fischeri | THEKFI |
| rouille de la canne à sucre | Puccinia kuehnii | PUCCKU |
| rouille de la canne à sucre | Puccinia melanocephala | PUCCML |
| rouille de la chicorée | Puccinia hieracii | PUCCHI |
| rouille de la cinéraire | Coleosporium tussilaginis f. sp. senecionis | COLSSE |
| rouille de la crotalaire | Uromyces decoratus | UROMDE |
| rouille de la fétuque | Uromyces dactylidis | UROMDA |
| rouille de la feuille du caféier | Hemileia vastatrix | HEMIVA |
| rouille de la fève | Uromyces viciae-fabae | UROMVF |
| rouille de la laitue | Puccinia hieracii | PUCCHI |
| rouille de la luzerne | Uromyces striatus | UROMST |
| rouille de la menthe | Puccinia menthae | PUCCME |
| rouille de la pivoine | Cronartium flaccidum | CRONFL |
| rouille de la raiponce | Coleosporium tussilaginis | COLSCP |
| rouille de la reine des prés | Triphragmium ulmariae | TPHRUL |
| rouille de la rhubarbe | Puccinia phragmitis | PUCCPH |
| rouille de la scabieuse | Puccinia verruca | PUCCVE |
| rouille de la tige | Puccinia graminis | PUCCGR |
| rouille de la tige de l'airelle | Pucciniastrum goeppertianum | PUCIGO |
| rouille de la tige de l'avoine | Puccinia graminis f. sp. avenae | PUCCGA |
| rouille de la tige de l'orge | Puccinia graminis f. sp. secalis | PUCCGS |
| rouille de la tige du blé | Puccinia graminis f. sp. tritici | PUCCGT |
| rouille de la tige du mil | Puccinia graminis subsp. graminicola | PUCCGM |
| rouille de la tige du seigle | Puccinia graminis f. sp. secalis | PUCCGS |
| rouille de la vigne | Phakopsora euvitis | PHLLAM |
| rouille de l'abricotier | Tranzschelia pruni-spinosae | TRANPS |
| rouille de l'ail | Puccinia allii | PUCCAL |
| rouille de l'aloès | Uromyces aloes | UROMAL |
| rouille de l'amandier | Melampsora amygdalinae | MELMAM |
| rouille de l'amandier | Tranzschelia pruni-spinosae | TRANPS |
| rouille de l'anémone pulsatille | Coleosporium tussilaginis f. sp. pulsatillae | COLSPU |
| rouille de l'arachide | Puccinia arachidis | PUCCAR |
| rouille de l'asperge | Puccinia asparagi[13] | PUCCAS |
| rouille de l'aster | Puccinia asteris | PUCCAT |
| rouille de l'aubépine | Gymnosporangium clavariiforme | GYMNCF |
| rouille de l'aubépine | Gymnosporangium confusum | GYMNCO |
| rouille de l'aubépine | Gymnosporangium globosum | GYMNGL |
| rouille de l'aubergine | Puccinia substriata | PUCCSU |
| rouille de l'endive | Puccinia hieracii | PUCCHI |
| rouille de l'épilobe du feu sur sapin | Pucciniastrum epilobii f. sp. abieti-chamaenerii | PUCIEA |
| rouille de l'hortensia | Pucciniastrum hydrangeae | PUCIHY |
| rouille de l'œillet | Puccinia arenariae | PUCCAE |
| rouille de l'œillet | Uromyces dianthi | UROMDI |
| rouille de l'Oregon des rosacées | Gymnosporangium juniperinum | GYMNJU |
| rouille de Plowright du poirier | Gymnosporangium confusum | GYMNCO |
| rouille de Virginie du poirier | Gymnosporangium globosum | GYMNGL |
| rouille de Virginie du pommier | Gymnosporangium juniperi-virginianae | GYMNJV |
| rouille des aiguilles de l'épicéa | Chrysomyxa abietis | CHMYAB |
| rouille des aiguilles de l'épicéa | Chrysomyxa weirii | CHMYWE |
| rouille des alliacées sur peuplier | Melampsora allii-populina | MELMAP |
| rouille des arbres fruitiers à noyau | Tranzschelia pruni-spinosae | TRANPS |
| rouille des euphorbiacées | Melampsora ricini | MELMRI |
| rouille des feuilles de bouleau | Melampsoridium betulinum | MELDBE |
| rouille des feuilles du blé | Puccinia triticina | PUCCRT |
| rouille des feuilles du cotonnier | Puccinia schedonnardi | PUCCSC |
| rouille des feuilles du mûrier | Mycosphaerella mori | MYCOMO |
| rouille des feuilles du peuplier | Melampsora medusae | MELMME |
| rouille des feuilles du seigle | Puccinia recondita f. sp. recondita | PUCCRR |
| rouille des iris | Puccinia iridis | PUCCIR |
| rouille des malvacées | Puccinia malvacearum [15] | PUCCMA |
| rouille des nervures du trèfle | Uromyces striatus | UROMST |
| rouille des ombellifères | Puccinia pimpinellae | PUCCPI |
| rouille des rameaux du pin | Cronartium filamentosum | CRONFI |
| rouille des rosacées | Phragmidium tuberculatum | PHRATU |
| rouille du balisier | Puccinia thaliae | PUCCTH |
| rouille du bananier | Uromyces musae | UROMMU |
| rouille du buis | Puccinia buxi | |
| rouille du caféier | Hemileia vastatrix | HEMIVA |
| rouille du carthame | Puccinia carthami | PUCCCR |
| rouille du carvi | Puccinia bistortae | PUCCCB |
| rouille du céleri | Puccinia apii | PUCCAP |
| rouille du cerisier | Puccinia cerasi | PUCCCE |
| rouille du cerisier | Pucciniastrum areolatum | PUCIAR |
| rouille du chrysanthème | Puccinia chrysanthemi [15] | PUCCCH |
| rouille du cognassier | Gymnosporangium clavipes | GYMNCL |
| rouille du collet | Puccinia coronata | PUCCCO |
| rouille du cotonnier | Phakopsora gossypii | PHAKGO |
| rouille du cotonnier | Puccinia cacabata | PUCCSK |
| rouille du crocus | Puccinia croci | PUCCCI |
| rouille du crocus | Uromyces croci | UROMCR |
| rouille du cytise | Uromyces laburni | UROMLA |
| rouille du cytise | Uromyces laburni f. sp. genistae-tinctoriae | UROMLG |
| rouille du dactyle | Uromyces dactylidis | UROMDA |
| rouille du dolique | Uromyces dolicholi | UROMDO |
| rouille du figuier | Cerotelium fici | KUEHFI |
| rouille du framboisier | Phragmidium rubi-idaei | PHRARU |
| rouille du fuchsia | Pucciniastrum epilobii | PUCIEP |
| rouille du fuchsia | Pucciniastrum epilobii f. sp. palustris | PUCIEL |
| rouille du fusain sur saule marsault | Melampsora epitea f. sp. euonymi-capraearum | MELMEP |
| rouille du genêt d'Angleterre | Uromyces laburni f. sp. anglicae | UROMLN |
| rouille du genêt des teinturiers | Uromyces laburni f. sp. genistae-tinctoriae | UROMLG |
| rouille du genévrier | Gymnosporangium juniperi-virginianae | GYMNJV |
| rouille du géranium | Uromyces geranii | UROMGE |
| rouille du glaïeul | Puccinia gladioli | PUCCGL |
| rouille du glaïeul | Uromyces gladioli | UROMGL |
| rouille du glaïeul | Uromyces transversalis [15] | UROMTV |
| rouille du goyavier | Puccinia psidii | PUCCPS |
| rouille du grand chiendent | Puccinia cynodontis | PUCCCY |
| rouille du groseillier | Puccinia ribis | PUCCRI |
| rouille du groseillier sur l'osier | Melampsora ribesii-viminalis | MELMRV |
| rouille du haricot | Uromyces appendiculatus | UROMAP |
| rouille du laiteron | Coleosporium tussilaginis f. sp. sonchi | COLSSO |
| rouille du lin | Melampsora lini | MELMLI |
| rouille du lin | Melampsora lini var. liniperda | MELMLL |
| rouille du mahonia | Uropyxis mirabilissima | CUMMMI |
| rouille du maïs | Puccinia polysora | PUCCPY |
| rouille du maïs | Puccinia sorghi | PUCCSO |
| rouille du manioc | Uromyces manihotis | UROMMA |
| rouille du mélèze sur peuplier | Melampsora larici-populina | MELMLP |
| rouille du millet | Puccinia substriata | PUCCSU |
| rouille du muflier des jardins | Puccinia antirrhini [15] | PUCCAN |
| rouille du mûrier | Cerotelium fici | KUEHFI |
| rouille du néflier | Gymnosporangium confusum | GYMNCO |
| rouille du pâturin | Puccinia poarum | PUCCPR |
| rouille du pâturin | Uromyces dactylidis var. poae | UROMDP |
| rouille du pêcher | Puccinia cerasi | PUCCCE |
| rouille du pêcher | Tranzschelia discolor | TRANDI |
| rouille du pêcher | Tranzschelia pruni-spinosae | TRANPS |
| rouille du pélargonium | Puccinia pelargonii-zonalis | PUCCPZ |
| rouille du pélargonium zonal | Puccinia pelargonii-zonalis | PUCCPZ |
| rouille du persil | Puccinia nitida | PUCCNI |
| rouille du persil | Puccinia rubiginosa | PUCCRU |
| rouille du peuplier | Melampsora larici-populina | MELMLP |
| rouille du peuplier | Melampsora populnea | MELMPO |
| rouille du peuplier sur la mercuriale | Melampsora rostrupii | MELMPR |
| rouille du peuplier sur le mélèze | Melampsora larici-tremulae | MELMPL |
| rouille du pin | Cronartium comandrae | CRONCO |
| rouille du pin à cinq feuilles | Cronartium ribicola | CRONRI |
| rouille du pin du Lord | Cronartium ribicola | CRONRI |
| rouille du pin Weymouth | Cronartium ribicola | CRONRI |
| rouille du pistachier | Pileolaria terebinthi | UROMTE |
| rouille du poireau | Puccinia porri | PUCCPO |
| rouille du poirier japonais | Gymnosporangium asiaticum | GYMNAS |
| rouille du poirier japonais | Gymnosporangium haraeanum | GYMNHA |
| rouille du pois | Uromyces pisi | UROMPS |
| rouille du pois | Uromyces viciae-fabae | UROMVF |
| rouille du pois à vache | Uromyces vignae | UROMVI |
| rouille du pois cajan | Uredo cajani | UREDCA |
| rouille du pois-chiche | Uromyces ciceris-arietini | UROMCA |
| rouille du prunier | Tranzschelia pruni-spinosae | TRANPS |
| rouille du rhododendron | Chrysomyxa ledi var. rhododendri | CHMYRH |
| rouille du ricin | Melampsora ricini | MELMRI |
| rouille du roseau | Puccinia phragmitis | PUCCPH |
| rouille du rosier | Phragmidium mucronatum | PHRAMU |
| rouille du salsifis | Puccinia jackyana | PUCCJA |
| rouille du sapin | Pucciniastrum goeppertianum | PUCIGO |
| rouille du sarrasin | Coleosporium tussilaginis f. sp. melampyri | COLSME |
| rouille du saule argenté | Melampsora salicis-albae | MELMSA |
| rouille du soja | Phakopsora pachyrhizi | PHAKPA |
| rouille du sorgho | Puccinia purpurea | PUCCPU |
| rouille du teck | Olivea tectonae | OLIVTE |
| rouille du tournesol | Puccinia helianthi | PUCCHE |
| rouille du trèfle | Uromyces trifolii | UROMTR |
| rouille écidienne du groseillier | Puccinia caricina var. pringsheimiana | PUCCCP |
| rouille écidienne du groseillier | Puccinia ribesii-caricis | PUCCRC |
| rouille en colonnettes du cassissier | Cronartium ribicola | CRONRI |
| rouille européenne du poirier | Gymnosporangium sabinae | GYMNFU |
| rouille européenne du pommier | Gymnosporangium juniperinum | GYMNJU |
| rouille européenne du pommier | Gymnosporangium tremelloides | GYMNTR |
| rouille grillagée du poirier | Gymnosporangium sabinae[16] | GYMNFU |
| rouille grillagée du pommier | Gymnosporangium juniperinum | GYMNJU |
| rouille grillagée du pommier | Gymnosporangium tremelloides | GYMNTR |
| rouille grise de la feuille du caféier | Hemileia coffeicola | HEMICO |
| rouille japonaise du chrysanthème | Puccinia horiana | PUCCHN |
| rouille japonaise du pommier | Gymnosporangium yamadae | GYMNYA |
| rouille jaune de l'orge | Puccinia striiformis | PUCCST |
| rouille jaune des graminées | Puccinia striiformis | PUCCST |
| rouille jaune du blé | Puccinia striiformis | PUCCST |
| rouille jaune du dactyle | Puccinia striiformis var. dactylidis | PUCCSD |
| rouille jaune du framboisier | Phragmidium rubi-idaei | PHRARU |
| rouille jaune du pâturin | Puccinia brachypodii var. poae-nemoralis | PUCCBP |
| rouille jaune du pâturin | Puccinia striiformis | PUCCST |
| rouille jaune du seigle | Puccinia striiformis | PUCCST |
| rouille jaune striée de l'orge | Puccinia striiformis | PUCCST |
| rouille jaune striée du blé | Puccinia striiformis | PUCCST |
| rouille jaune tardive du framboisier | Pucciniastrum americanum | PUCIAM |
| rouille linéaire des céréales | Puccinia graminis | PUCCGR |
| rouille naine de l'orge | Puccinia hordei | PUCCHD |
| rouille naine des feuilles de l'orge | Puccinia hordei | PUCCHD |
| rouille noire | Puccinia graminis[17] (Ug99) | PUCCGR |
| rouille noire de la fléole | Puccinia graminis subsp. graminicola | PUCCGM |
| rouille noire de l'agrostide | Puccinia graminis subsp. graminicola | PUCCGM |
| rouille noire de l'avoine | Puccinia graminis f. sp. avenae | PUCCGA |
| rouille noire des céréales | Puccinia graminis | PUCCGR |
| rouille noire des ronces | Phragmidium bulbosum | PHRABU |
| rouille noire des ronces | Phragmidium violaceum | PHRAVI |
| rouille noire du blé | Puccinia graminis f. sp. tritici | PUCCGT |
| rouille noire du chrysanthème | Puccinia chrysanthemi | PUCCCH |
| rouille noire du dactyle | Puccinia graminis subsp. graminicola | PUCCGM |
| rouille noire du groseillier | Puccinia ribis | PUCCRI |
| rouille noire du seigle | Puccinia graminis f. sp. secalis | PUCCGS |
| rouille noire européenne du framboisier | Phragmidium rubi-idaei | PHRARU |
| rouille orangée de la patate douce | Coleosporium ipomoeae | COLSIP |
| rouille orangée du framboisier | Gymnoconia interstitialis | GYMCIN |
| rouille pâle des ronces | Kuehneola uredinis | KUEHUR |
| rouille péruvienne de la pomme de terre | Aecidium cantense | AECICT |
| rouille poudreuse du caféier | Hemileia coffeicola | HEMICO |
| rouille tordeuse des rameaux du pin | Melampsora pinitorqua | MELMPP |
| rouille tropicale du maïs | Physopella zeae | PHLLZE |
| rouille vésiculaire des aiguilles | Melampsorella caryophyllacearum | MELRCA |
| rouille vésiculaire des aiguilles de l'épicéa | Chrysomyxa ledi var. rhododendri | CHMYRH |
| rouille vésiculeuse de l'écorce du pin | Cronartium flaccidum | CRONFL |
| rouille vésiculeuse des aiguilles du pin | Coleosporium tussilaginis | COLSTU |
| rouille vésiculeuse du chêne | Cronartium fusiforme | CRONFU |
| rouille vésiculeuse du pin | Cronartium fusiforme | CRONFU |
| rouille vésiculeuse du pin blanc | Cronartium ribicola | CRONRI |
Notes et références
- (de) Julia Marlene Kruse, Faszinierende Pflanzenpilze Erkennen und Bestimmen, Quelle&Meyer, , 528 p. (ISBN 978-3-494-01780-8)
- Matthew J. Moscou, H. Peter van Esse (2017), The quest for durable resistance Science 22 Dec 2017: Vol. 358, Issue 6370, pp. 1541-1542 DOI: 10.1126/science.aar4797 (résumé
- (de) Friedemann Klenke & Markus Scholler, Pflanzenparasitische Kleinpilze : Bestimmungsbuch für Brand-, Rost-, Mehltau-, Flagellatenpilze und Wucherlingsverwandte in Deutschland, Österreich, der Schweiz und Südtirol, Berlin, Heidelberg, Springer Spektrum, , 1174 p. (ISBN 978-3-662-46162-4, DOI 10.1007/978-3-662-46162-4)
- Georges Viennot-Bourgin, Mildious, oïdiums, caries et charbons, rouilles des plantes de la France, chez Lechevalier, , 350 p. (ISBN 9782720504105)
- Marcel Lecomte, « Les Rouilles », sur Association des mycologues francophones de Belgique (AMFB)
- Roger Corbaz, Principes de phytopathologie et de lutte contre les maladies des plantes, Presses polytechniques et universitaires romandes, (lire en ligne), p. 21
- Roger Corbaz, op. cit., p. 23-29
- Roger Corbaz, op. cit., p. 31
- Roger Corbaz, op. cit., p. 33
- Quels traitements naturels utiliser pour un potager bio ? sur le site Bioaddict, consulté en novembre 2011
- Guide Clause, 13° édition, 1952, p. 369
- Rustica 18/12/2011
- La production des asperges biologiques
- Index phytosanitaire ACTA des années 1977, 1985 & 2006 ; Association de coordination technique agricole, Paris
- Jacques Barnouin, Ivan Sache et al. (préf. Marion Guillou), Les maladies émergentes : Épidémiologie chez le végétal, l'animal et l'homme, Versailles, Quæ, coll. « Synthèses », , 444 p. (ISBN 978-2-7592-0510-3, ISSN 1777-4624, lire en ligne), I. Facettes et complexité de l'émergence, chap. 2 (« Les maladies émergentes affectant les végétaux »), p. 25, accès libre.
- La rouille grillagée du poirier, une maladie disgracieuse
- Rouille noire des Graminées

.jpg.webp)