Réaction de Wurtz-Fittig
La réaction de Wurtz-Fittig est une réaction de couplage entre un halogénure d'aryle et un halogénure d'alkyle en présence de sodium métallique, formant de composés aromatique alkylés[1].

C'est une adaptation de la réaction de Wurtz – une réaction similaire mais entre deux halogénure d'alkyle produisant un alcane supérieur par création d'une nouvelle liaison carbone-carbone[2] - [3] découverte par le chimiste français Charles Adolphe Wurtz en 1855[4] - [5] – faite par le chimiste allemand Rudolph Fittig au début des années 1860, qui cherchait à produire des dérivés alkylés du benzène[6] - [7], en particulier le toluène. Cette modification est considérée comme un procédé séparé, et la réaction est nommée d'après les deux chimistes[1]. Du fait de réactions parasites, son rendement est faible, et elle n'a de nos jours que peu d'intérêt synthétique.
Historique
Vers 1860, Rudolph Fittig s'intéresse aux dérivés du benzène, dont la structure était encore inconnue. Il s'intéresse notamment aux bromobenzènes qu'il cherche à transformer en alkylbenzènes, en s'inspirant de réactions fonctionnant pour de composés aliphatiques. Il tente ainsi infructueusement de faire réagir le bromobenzène avec le cyanure pour obtenir le benzonitrile, avant d'adapter la réaction de Wurtz. Son premier essai concluant fut la réaction entre le chlorure de benzyle et le bromobenzène, produisant le diphénylméthane :
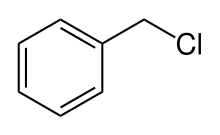 +
+ 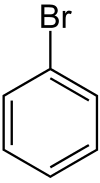 + 2 Na →
+ 2 Na → 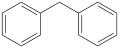 + NaBr + NaCl
+ NaBr + NaCl
Par la suite, il développera cette méthode[2] - [3] avec Bernhard Tollens, et parviendra à produire une bonne partie de la série homologue des alkylbenzènes : toluène, éthylbenzène, propylbenzène, butylbenzène[6] - [7].
Mécanisme

Dans une première étape, l'halogénure d'alkyle qui est plus réactif que l'halogénure d'aryle est réduit en carbanion. Ce dernier réagit ensuite par substitution nucléophile avec l'halogénure d'aryle pour former l'alkylbenzène[8].
Réactions parasites
De nombreuses réactions parasites peuvent se produire, réduisant le rendement de le réaction. On peut citer :

- elle nécessite un hydrogène β dans le radical alkyle de l'halogénoalcane (1). Le carbanion (2) présent un fort caractère basique, et va alors arracher un proton à un autre halogénoalcane, qui va ensuite éliminer son atome d'halogène. Cette réaction produit un alcane (3) et un alcène (4).

- il s'agit simplement de la réaction de Wurtz de l'halogénoalcane sur lui-même : couplage du carbanion (1) avec l'halogénoalcane (2), produisant un alcane supérieur (3).
- réaction de couplage

- Alternativement, le couplage parasite peut se faire entre deux halogénures d'aryle (1). Le carbanion (2) aromatique formé réagit avec un autre halogénure d'aryle, produisant un biphényle (3). Cette réaction est cependant rare du fait de la faible réactivité des halogénures d'aryle[9].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Wurtz-Fittig-Synthese » (voir la liste des auteurs).
- Zerong Wang, Comprehensive Organic Name Reactions and Reagents, vol. 686, (ISBN 978-0-470-63885-9, DOI 10.1002/9780470638859.conrr686), « Wurtz–Fittig Reaction », p. 3100–3104.
- « Wurtz Synthesis (Wurtz Reaction, Wurtz Reductive Coupling) », Comprehensive Organic Name Reactions and Reagents, vol. 685, , p. 3094–3099 (DOI 10.1002/9780470638859.conrr685)
- Eric Asssen B. Kantchev et Michael G. Organ, Alkanes, vol. 48, Georg Thieme Verlag, coll. « Science of Synthesis: Houben-Weyl Methods of Molecular Transformations », (ISBN 978-3-13-178481-0, lire en ligne), « 48.1.2.4 Method 4: Reductive Coupling of Alkyl Halides »
- Adolphe Wurtz, « Sur une Nouvelle Classe de Radicaux Organiques » [« On a New Class of Organic Radicals »], Annales de chimie et de physique, vol. 44, , p. 275–312 (lire en ligne)
- (de) A. Wurtz, « Ueber eine neue Klasse organischer Radicale » [« About a new class of organic radicals »], Justus Liebigs Annalen der Chemie, vol. 96, no 3, , p. 364–375 (DOI 10.1002/jlac.18550960310, lire en ligne)
- (de) Bernhard Tollens et Rudolph Fittig, « Ueber die Synthese der Kohlenwasserstoffe der Benzolreihe » [« On the synthesis of the hydrocarbons of the benzene series »], Justus Liebigs Annalen der Chemie, vol. 131, no 3, , p. 303–323 (DOI 10.1002/jlac.18641310307, lire en ligne)
- (de) Rudolph Fittig et Joseph König, « Ueber das Aethyl- und Diäthylbenzol » [« About ethyl- and diethylbenzene »], Justus Liebigs Annalen der Chemie, vol. 144, no 3, , p. 277–294 (DOI 10.1002/jlac.18671440308, lire en ligne)
- László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis, Elsevier Science & Technology Books, , 758 p. (ISBN 0-12-369483-3), p. 498
- T. Laue et A. Plagens, Namens- und Schlagwortreaktionen der Organischen Chemie, Teubner Verlag, (ISBN 3-8351-0091-2), p. 360