Réaction de Briggs-Rauscher
La réaction oscillante de Briggs-Rauscher est une des quelques réactions oscillantes connues. Elle est particulièrement bien adaptée à des fins de démonstration en raison de ses changements de couleur saisissants : la solution fraîchement préparée incolore prend progressivement une couleur ambrée, puis passe tout à coup à un bleu très foncé. Cette coloration s'estompe lentement, la solution redevenant incolore, et le processus se répète, une dizaine de fois dans la formulation la plus connue, avant de se terminer par un liquide de couleur bleu foncé avec une forte odeur d'iode.
Histoire
La première réaction chimique oscillante connue fut rapporté par W.C. Bray en 1921[1]. Elle mettait en œuvre du peroxyde d'hydrogène (H2O2) et l'ion iodate (IO3−) dans une solution acide. En raison de difficultés expérimentales, elle attira peu l'attention et ne convenait pas aux démonstrations. En 1958, le chimiste soviétique Boris Pavlovitch Belooussov découvre la réaction de Belooussov-Jabotinski (réaction BZ)[2] qui convient pour une démonstration, mais elle aussi est accueillie avec scepticisme (en grande partie parce que de tels comportements oscillatoires étaient inconnus à cette époque) jusqu'à ce que A.M. Zhabotinsky, également en URSS, en prenne connaissance et, en 1964, publie ses recherches[3]. En , deux articles dans le Journal of Chemical Education[4] - [5], attirent l'attention de deux professeurs de sciences au Lycée Galilée à San Francisco. Ils découvrent alors la réaction oscillante de Briggs-Rauscher[6] en remplaçant le bromate (BrO3−) de la réaction BZ par de l’iodate, en ajoutant aussi du peroxyde d'hydrogène. Ils produisent une démonstration visuelle frappante en ajoutant de l'empois d'amidon. Depuis, de nombreux autres chercheurs ont ajouté leur pierre à l’édifice de la connaissance et de l’utilisation de cette réaction très inhabituelle.
Description
Conditions initiales
La solution aqueuse initiale contient du peroxyde d'hydrogène, un ion iodate, du manganèse divalent (Mn2+) comme catalyseur, un acide fort non-chimiquement réactif (acide sulfurique (H2SO4) ou acide perchlorique (HClO4) conviennent), et un composé organique avec un atome d'hydrogène actif (« énolique ») attaché à un carbone (l’acide malonique (CH2(COOH)2) par exemple) qui permettra de réduire lentement l’iode libre (I2) en iodure (I−). De l'empois d'amidon est éventuellement ajouté comme indicateur pour montrer l'augmentation brusque de la concentration de l'ion iodure, par un changement soudain de la couleur de la solution de l'ambré (dû à l'iode) au bleu foncé (le « complexe iode-amidon », ce qui nécessite à la fois du diiode et de l'iodure)[7].
Récemment, il a été démontré que l’amidon n’est pas seulement un indicateur de la présence d’iode dans la réaction[8]. En présence d'amidon, le nombre d'oscillations est plus élevé et les durées de période plus longues par rapport aux mélanges sans amidon. Il a également été constaté que le segment de la consommation d'iode au cours d'une période d'oscillation est également nettement plus long dans les mélanges contenant de l'amidon. Cela suggère que l'amidon joue probablement un rôle de réservoir pour l'iode et l'iodure en raison de l'équilibre amidon-triiodure, ce qui modifie la cinétique des étapes dans lesquelles interviennent l'iode et l'iodure.
La réaction est « empoisonnée » par les ions chlorure (Cl−), qui doivent donc être évités. La réaction va osciller dans une gamme de concentrations initiales assez large. Pour les recettes convenant à des fins de démonstration, voir Shakhashiri[9] ou Préparations dans les liens externes.
Comportement dans le temps
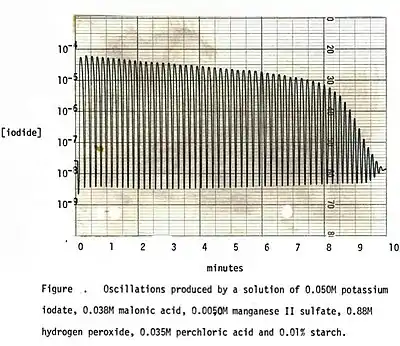
La réaction montre des changements récurrents périodiques, à la fois graduels et soudains, qui sont visibles : changements lents de l'intensité des couleurs, interrompues par de brusques changements de teinte. Cela démontre qu'une combinaison complexe de réactions lentes et rapides se déroule simultanément. Par exemple, le suivi de la concentration en ions iodure avec une électrode d’argent/iodure d'argent[6] (voir les vidéos) montre des sauts soudains de plusieurs ordres de grandeur séparés par des variations plus lentes. Ceci est représenté par l'oscillogramme ci-dessus. Les oscillations persistent sur une large gamme de températures. Des températures plus élevées accélèrent tout le processus, avec quelques changements qualitatifs observables (voir effet de la température). L’agitation de la solution pendant toute la réaction permet d’obtenir des changements de couleur nets, sinon des variations spatiales peuvent se développer (voir les vidéos). Des bulles d'oxygène libre évoluent tout au long de la réaction, et dans la plupart des cas, l'état final est riche en iode libre.
Variantes
Modification des concentrations initiales
Comme indiqué plus haut, la réaction oscille dans une gamme de concentrations initiales en réactifs assez large[10]. Pour les démonstrations oscillométriques, plus de cycles sont obtenus dans des solutions diluées, qui produisent des changements de couleur plus faibles. Voir par exemple le graphique, qui montre plus de 40 cycles en 8 minutes.
Modification du substrat organique
L'acide malonique peut être remplacé par d'autres molécules organiques adaptées[11], telles que l'acétone (CH3COCH3) ou l'acétylacétone(CH3COCH2COCH3). Des substrats plus exotiques peuvent être utilisés[12] - [13]. Les enregistrements oscillographiques résultant montrent souvent des traits distinctifs, par exemple tel que ceux rapportés par Szalai[14].
Réacteurs à flux continu
La réaction peut être rendue oscillante indéfiniment en utilisant un réacteur à écoulement continu à cuve agitée (CSTR - continuous flow stirred tank reactor), dans lequel les réactifs de départ sont introduits en continu et le liquide en excès est aspiré[15] - [16].
Graphiques dans l'espace des phases à deux dimensions
En omettant l'amidon et en surveillant la concentration en diiode (I2) par photométrie, c’est-à-dire par la mesure de l'absorption d'un faisceau de lumière adapté à travers la solution, tout en surveillant simultanément la concentration en ion iodure avec une électrode sélective à iodure, on obtient un graphique XY présentant une spirale déformée. Dans un réacteur à écoulement continu, cela devient une boucle fermée (cycle limite).
Démonstration fluorescente
En remplaçant l'amidon par un colorant fluorescent, Weinberg et Muyskens (2007) ont produit une manifestation visible dans le noir sous lumière ultraviolette[17].
Utilisation comme dosage biologique
La réaction a été proposée comme une procédure de dosage pour les antioxydants dans les aliments[18]. L'échantillon à tester est ajouté au début des oscillations, la durée jusqu'à l'arrêt des oscillations est alors proportionnelle à son activité antioxydante. Comparée aux méthodes d'analyse existantes, cette procédure est rapide et facile, et elle s’effectue au pH de l'estomac humain[19]. Contrairement aux constatations précédentes qui concernaient principalement les composés polyphénoliques, il a été constaté que l’acide salicylique - un simple composé monophénolique - n’arrête pas immédiatement les oscillations du mélange actif de Briggs-Rauscher[20]. À faibles concentrations, l'acide salicyclique n'a fait qu'atténuer les oscillations, tandis qu'à des concentrations plus élevées, l'effet d'amortissement était beaucoup plus fort et une inhibition complète a finalement été observée[21]. L'acide sulfosalicylique, un dérivé de l'acide salicyclique, n'a pratiquement pas affecté les oscillations.
Pour une description détaillée adaptée à un niveau d’école supérieure de chimie, voir Préparation.
Mécanisme chimique
Le mécanisme détaillé de cette réaction est assez complexe[10] - [22]. Néanmoins, une bonne explication générale peut être donnée.
Les caractéristiques essentielles du système dépendent de deux processus clés. Ces processus impliquent chacun de nombreuses réactions qui se produisent simultanément :
- A ("processus non radicalaire") : La consommation lente de l'iode libre par le substrat d'acide malonique en présence d'iodate. Ce processus implique la production intermédiaire de l'ion iodure,
- B processus radical : un processus rapide auto-catalysé impliquant le manganèse et des radicaux libres intermédiaires, convertit le peroxyde d'hydrogène et iodate en iode et oxygène libre. Ce processus peut également consommer de l’iodure jusqu'à une vitesse limite.
Mais le procédé B peut fonctionner seulement à de faibles concentrations d'iodure, créant une boucle de rétroaction comme suit:
Initialement, la concentration d'iodure est faible et le processus B génère de l’iode libre, qui s’accumule progressivement. Pendant ce temps, le processus A génère lentement des ions iodure intermédiaires à partir de l’iode libre à un taux proportionnel à sa concentration (i.e. I2) croissante. À un certain moment, ce processus prend le dessus sur le processus B, arrêtant la production d'iode libre, qui est toujours consommée par le processus A. Ainsi, la concentration d'iode libre (et donc iodure) peut tomber assez bas pour que le processus B puisse démarrer à nouveau et le cycle se répète tant que les réactifs originaux subsistent.
Le résultat global de ces deux processus est (encore une fois, approximativement)[6].
- IO3− + 2H2O2 + CH2(COOH)2 + H+ → ICH(COOH)2 + 2O2 + 3H2O
Les changements de couleur observés au cours de la réaction correspondent aux actions des deux processus : la couleur ambrée qui augmente lentement est due à la production d'iode libre par le processus B. Lorsque le processus B s’arrête, l'augmentation résultante de l'ion iodure permet l’apparition soudaine de la couleur bleue de l'amidon. Mais puisque le procédé A est toujours actif, celle-ci s’estompe lentement jusqu’à s’effacer. La reprise éventuelle du procédé B est invisible, mais peut être révélée grâce à une électrode adaptée.
Une boucle de rétroaction négative qui comprend un retard (réalisé ici par le processus A) est un mécanisme général pour la production d'oscillations dans de nombreux systèmes physiques, mais est très rare dans les systèmes chimiques homogènes non biologiques. La réaction BZ oscillante a une boucle de rétroaction à peu près semblable.
Liens externes
Vidéos
- Démonstration agitée en continu montrant des changements rapides et uniformes de couleur.
- Démonstration continuellement agitée montrant 16 oscillations colorées augmentant progressivement en intensité.
- Démonstration non agitée montrant les variations spatiales mineures.
- Démonstration non agitée montrant les variations spatiales très importante.
- Cette démonstration s'achève avec 19 cycles. Ici le complexe d'amidon bleu apparaît tardivement, si bien que les variations de l'iode libre sont bien visibles.
- This demo completes in 13 cycles. Cette démonstration s'achève en 13 cycles. Une électrode sélective d'iodure est utilisé pour produire un graphique de I− en temps réel.
Effet de la température
Références
- W. C. Bray, « A Periodic Reaction in Homogeneous Solution and Its Relation to Catalysis », J. Am. Chem. Soc., vol. 43, no 6, , p. 1262–1267 (DOI 10.1021/ja01439a007)
- Belousov, B. P. (1958), "A Periodic Reaction and Its Mechanism", Sbornik Referatov po Radiatsionni Meditsine, Medgiz, Moscow, p. 145. (transl. in Field and Burger, Op.Cit., below)
- (ru) A. M. Zhabotinskii, « ru:Периодические окислительные реакции в жидкой фазе » [« Periodic oxidation reactions in liquid phase »], Doklady Akademii Nauk SSSR, vol. 157, no 2, , p. 392–393
- Field, R. J. (1972), "A Reaction Periodic in Time and Space", J. Chem. Educ., 49, 308.
- Degn, Hans (1972), "Oscillating Chemical Reactions in Homogeneous Phase", J. Chem. Educ., 49, 302–307.
- Thomas S. Briggs and Warren C. Rauscher (1973), "An Oscillating Iodine Clock", J. Chem. Educ. 50, 496.
- J. A. Thoma and D. French, « The Starch-Iodine-Iodide Interaction. Part I. Spectrophotometric Investigations », J. Am. Chem. Soc., vol. 82, no 16, , p. 4144–4147 (DOI 10.1021/ja01501a004)
- L. I. Csepei et Cs. Bolla, « Is starch only a visual indicator for iodine in the Briggs-Rauscher oscillating reaction? », Studia UBB Chemia, vol. 60, , p. 187-199 (lire en ligne)
- Shakhashiri, B. Z. (1992) Chemical Demonstrations: A Handbook for Teachers of Chemistry Vol. II p. 248–256, University of Wisconsin Press, Madison, WI.
- Furrow, S. D. in Field, R. J. and M. Burger(1985), Oscillations and Traveling Waves in Chemical Systems, J. Wiley & Sons, New York.
- S. D. Furrow, « Comparison of Several Substrates in the Briggs–Rauscher Oscillating System », J. Phys. Chem., vol. 99, no 28, , p. 11131–11140 (DOI 10.1021/j100028a013)
- Stanley D. Furrow, « NewSubstrates for the Oscillating Briggs–Rauscher Reaction », J. Phys. Chem. A, vol. 106, , p. 5841–5850 (DOI 10.1021/jp0138779)
- Istvan Szalai et Istvan Szalai, « Briggs–Rauscher Reaction with 1,4-Cyclohexanedione Substrate », Z. Phys. Chem., vol. 220, no 8, , p. 1071–1082 (DOI 10.1524/zpch.2006.220.8.1071)
- A. Pacault, P. Hanusse, P. De Kepper, C. Vidal and J. Boissonade, « Phenomena in homogeneous chemical systems far from equilibrium », Acc. Chem. Res., vol. 9, no 12, , p. 438–445 (DOI 10.1021/ar50108a003)
- Merino, J. M.(1992), "A simple,continuous-flow stirred-tank reactor for the demonstration and investigation of oscillating reactions", J. Chem. Educ. 69, p. 754.
- Richard B. Weinberg et Mark Muyskens, « An Iodine Fluorescence Quenching Clock Reaction », J. Chem. Educ., vol. 84, , p. 797 (DOI 10.1021/ed084p797, Bibcode 2007JChEd..84..797W, lire en ligne)
- R. Cervellati, K. Höner, Stanley D. Furrow, C. Neddens and S. Costa, « The Briggs–Rauscher Reaction as a Test to Measure the Activity of Antioxidants », Helvetica Chimica Acta, vol. 84, no 12, , p. 3533–3547 (DOI 10.1002/1522-2675(20011219)84:12<3533::AID-HLCA3533>3.0.CO;2-Y)
- R. Cervellati, C. Renzulli, M. C. Guerra and E. Speroni, « Evaluation of Antioxidant Activity of Some Natural Polyphenolic Compounds Using the Briggs–Rauscher Reaction Method », J. Agric. Food Chem., vol. 50, no 26, , p. 7504–7509 (DOI 10.1021/jf020578n)
- L. I. Csepei et Cs. Bolla, « Study on the Inhibition of Briggs-Rauscher Oscillating Reaction », Studia UBB Chemia, , p. 249 (lire en ligne)
- L. I. Csepei et Cs. Bolla, « The Effect of Salicylic Acid on the Briggs-Rauscher Oscillating Reaction », Studia UBB Chemia, vol. 61, no 1, , p. 285 (lire en ligne)
- R. M. Noyes and S. D. Furrow, « The oscillatory Briggs–Rauscher reaction. 3. A skeleton mechanism for oscillations », J. Am. Chem. Soc., vol. 104, no 1, , p. 45–48 (DOI 10.1021/ja00365a011)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Briggs–Rauscher reaction » (voir la liste des auteurs).