Réaction d'Étard
La réaction d'Étard est une réaction d'oxydation organique des groupes méthyle, liés à un cycle aromatique ou un hétérocycle, en groupe aldéhyde par le chlorure de chromyle[1] - [2] - [3]. Elle tient son nom du chimiste français Alexandre Étard. Cette réaction permet par exemple d'oxyder le toluène en benzaldéhyde :
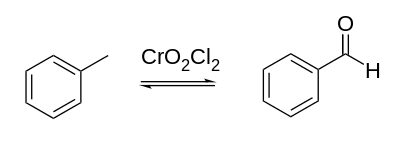
Mécanisme réactionnel
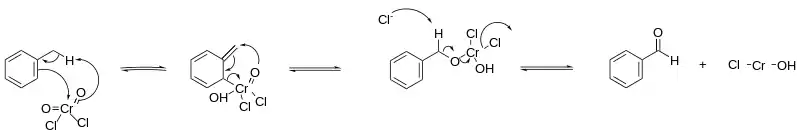
Le mécanisme réactionnel se déroule selon une réaction ène avec le chlorure de chromyle, formant un précipité, le complexe d'Étard. Ce complexe se décompose ensuite par un réarrangement sigmatropique [2,3] sous conditions réductrices, pour éviter une oxydation supplémentaire en acide carboxylique. De telles conditions sont obtenues en saturant la solution par du sulfite de sodium. En général on utilise un solvant du type sulfure de carbone, chloroforme ou encore tétrachlorure de carbone, ce dernier étant moins courant. Pour obtenir un aldéhyde le plus pur possible, le complexe d'Étard est souvent purifié avant sa décomposition, afin d'éviter toute r!action avec un réactif qui n'aurait pas encore réagit. On laisse en général cette réaction durer plusieurs jours à plusieurs semaines, et son rendement est assez élevé[4] - [5].
Limites
La réaction d'Étard est avant tout utilisée comme méthode de conversion facile du toluène en benzaldéhyde. Obtenir des aldéhydes spécifique à partir de réactifs autres que le toluène tend à être délicat du fait des réarrangements. Par exemple, le n-propylbenzène est oxydé en phénylacétone, propiophénone et d'autres dérivés chlorés, la première étant le produit majoritaire[6] - [7].
Un autre exemple est la réaction de la trans-décaline qui résulte en un mélange de trans-9-décalol, de spiro[4.5]décan-6-one, de trans-1-décalone, de cis-1-décalone, de 9,10-octal-1-one et de 1-tétralone[8].
D'autre oxydants comme le permanganate de potassium ou le dichromate de potassium oxydent les composés en acides carboxyliques plus stables.
Utilisations
L'oxydation du toluène en benzaldéhyde est une réaction utile. Le benzaldéhyde est souvent utilisé comme arôme d'amande. L'aldéhyde est aussi plus réactif et peut participer aux réactions de crotonisation. Le benzaldéhyde peut aussi servir de précurseur à de nombreux composés, comme des pigments, des parfums et des composés pharmaceutiques. Par exemple, la première étape de la synthèse de l'éphédrine est la condensation du benzaldéhyde avec le nitroéthane. Le benzaldéhyde peut aussi être utilisé dans la synthèse de la phentermine[9].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Étard reaction » (voir la liste des auteurs).
- Étard, A., « Sur la synthèse des cétones aromatiques; essence de cumin », Comptes-rendus hebdomadaires des Séances de l'Académie des Sciences, vol. 90, , p. 534 (lire en ligne [archive du ])
- Étard, A., « Recherches sur le rôle oxydant de l'acide chlorochromique », Annales de Chimie et de Physique, vol. 22, , p. 218–286 (lire en ligne [archive du ])
- Hartford, W. H. and Darrin, M., « The Chemistry Of Chromyl Compounds », Chemical Reviews, vol. 58, , p. 1–61 (DOI 10.1021/cr50019a001)
- Necsoiu, I.; Balaban, A. T.; Pascaru, I.; Sliam, E.; Elian, M.; and Nenitzescu, C. D., « The mechanism of the Étard reaction », Tetrahedron, vol. 19, no 7, , p. 1133–1142
- Wheeler, Owen H., « Étard Reaction: I. Its Scope and Limitation with Substituted Toluenes », Canadian Journal of Chemistry, vol. 36, , p. 667–670 (lire en ligne [archive du ])
- Renţea, C. N.; Necşoiu, I.; Renţes, M.; Ghenciulescu, A. and Nenitzescu, C. D., « Étard reaction—III: Oxidation of N-propylbenzene and methylcyclohexane with chromyl chloride », Tetrahedron, vol. 22, no 10, , p. 3501–3513
- Wiberg, K. B.; Marshall, B. and Foster, G., « Some observations on the Étard reaction », Tetrahedron Letters, vol. 3, no 8, , p. 345–348
- Renţea, C. N.; Renţea, M.; Necşoiu, I. and Nenitzescu, C. D., « Étard reaction—VI: Oxidation of cis and trans-decaline with chromyl chloride », Tetrahedron, vol. 24, no 13, , p. 4667–4676
- (en) Vardanyan, Ruben S. and Hruby, Victor J., Synthesis of Essential Drugs, Amsterdam, Elsevier Science, , first éd., 617 p. (ISBN 978-0-444-52166-8)