Quadricyclane
Le quadricyclane est un hydrocarbure polycyclique tendu de formule chimique CH2(CH)6. Il s'agit d'un liquide volatil incolore. Sa tension de cycle élevée, de l'ordre de 329,5 kJ/mol, ne se relâche que lentement en donnant le norbornadiène, en l'absence de catalyseur[3]. Il fait l'objet de recherches pour le stockage de l'énergie, notamment de l'énergie solaire[4] - [5] - [6] - [7]. Ces applications sont toutefois limitées par sa température de décomposition thermique inférieure à 400 °C.
| Quadricyclane | |

| |
| Structure du quadricyclane | |
| Identification | |
|---|---|
| Nom UICPA | tétracyclo[3.2.0.02,7.04,6]heptane |
| No CAS | |
| No ECHA | 100.005.450 |
| No CE | 205-994-1 |
| PubChem | 78961 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C7H8 [Isomères] |
| Masse molaire[1] | 92,138 4 ± 0,006 2 g/mol C 91,25 %, H 8,75 %, |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Formation
Le quadricyclane se forme à partir de norbornadiène par irradiation par les ultraviolets de longueur d'onde jusqu'à 300 nm en présence de sensibilisants tels que la cétone de Michler[8] - [9]. Il est possible d'utiliser d'autres sensibilisants tels que l'acétone, la benzophénone, l'acétophénone et le chlorure de cuivre(I)[10], mais avec un rendement inférieur. Si les rendements sont optimaux avec du norbornadiène fraîchement distillé, ils restent satisfaisants avec les structures commercialisés[11].
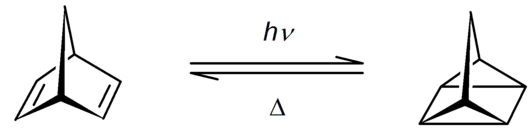 Conversion norbornadiène quadricyclane.
Conversion norbornadiène quadricyclane.
La réaction inverse est possible à des températures supérieures à 100 °C, en présence de complexes métalliques catalyseurs tels que les porphyrines métalliques[10] comme la phtalocyanine de cobalt sur substrat carbone, noté CoPc@C[12].
Applications
La relaxation du quadricyclane en norbornadiène libère l'énergie de tension de cycle sous forme d'une variation d'enthalpie ΔH = −89 kJ/mol. Cette réaction a été proposée pour le stockage de l'énergie solaire[3] - [13]. Cependant, la limite d'absorption des rayonnements électromagnétiques est de l'ordre de 300 nm alors que l'essentiel du rayonnement solaire se situe au-delà de 400 nm. Divers dérivés du norbornadiène, notés NBDn, et du quadricyclane, notés QCn, avec n = 1, 2, 3, etc., sont étudiés pour optimiser le stockage de l'énergie solaire dans ce type de matériaux[12] - [14].
Il a également été étudié comme additif de carburant ou de propergols en astronautique, mais sa décomposition thermique à moins de 400 °C limite ce potentiel, ces systèmes devant pouvoir fonctionner au-dessus de 500 °C[15].
Réactions
Le quadricyclane réagit facilement avec l'acide acétique pour donner un mélange d'acétate de nortricyclyle et d'acétate d’exo-norbornyle[3]. Il réagit également avec divers diénophiles pour former des adduits 1:1[11].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Quadricyclane (Compound) », sur https://pubchem.ncbi.nlm.nih.gov/, NIH > NLM > NCBI > PubChem (consulté le ).
- (en) Viacheslav A. Petrov et Nikolai V. Vasil'ev, « Synthetic Chemistry of Quadricyclane », Current Organic Synthesis, vol. 3, no 2, , p. 215-259 (lire en ligne)
- (en) Ambra Dreos, Zhihang Wang, Jonas Udmark, Anna Ström, Paul Erhart, Karl Börjesson, Mogens Brøndsted Nielsen et Kasper Moth-Poulsen, « Liquid Norbornadiene Photoswitches for Solar Energy Storage », Advanced Energy Materials, vol. 8, no 18, , article no 1703401 (DOI 10.1002/aenm.201703401, lire en ligne)
-
(en) Mads Mansø, Anne Ugleholdt Petersen, Zhihang Wang, Paul Erhart, Mogens Brøndsted Nielsen et Kasper Moth-Poulsen, « Molecular solar thermal energy storage in photoswitch oligomers increases energy densities and storage times », Nature Communications, vol. 9, no 1, , article no 1945 (PMID 29769524, PMCID 5956078, DOI 10.1038/s41467-018-04230-8, Bibcode 2018NatCo...9.1945M, lire en ligne
 )
) - (en) « Emissions-free energy system saves heat from the summer sun for winter », sur https://www.mynewsdesk.com/, (consulté le ).
- (en) Wayt Gibbs, « Scientists are trying to bottle solar energy and turn it into liquid fuel », sur https://www.nbcnews.com/, NBCNews.com, (consulté le ).
- (en) P. S. Kalsi, Organic Reactions And Their Mechanisms, New Age International, 2000, p. 366. (ISBN 978-8-122-41268-0)
- (en) Paul Cahill et Richard Steppel pour Exciton Inc, Brevet U.S. 20040054244A1 : Process of quadricyclane production, déposé le 12 septembre 2003, publié le 18 mars 2004, sur Google Patents.
- (de) Dieter Wöhrle, Michael W. Tausch et Wolf-Dieter Stohrer, Photochemie: Konzepte, Methoden, Experimente, Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer, John Wiley & Sons, 2012. (ISBN 3-527-66088-7)
- (en) Claibourne D. Smith, « Quadricyclane », Organic Syntheses, vol. 51, , p. 133 (DOI 10.15227/orgsyn.051.0133, lire en ligne)
-
(en) Zhihang Wang, Anna Roffey, Raul Losantos, Anders Lennartson, Martyn Jevric, Anne U. Petersen, Maria Quant, Ambra Dreos, Xin Wen, Diego Sampedro, Karl Börjesson et Kasper Moth-Poulsen, « Macroscopic heat release in a molecular solar thermal energy storage system », Energy & Environmental Science, vol. 12, no 1, , p. 187-193 (DOI 10.1039/c8ee01011k, lire en ligne
 )
) - (en) Constantine Philippopoulos, Dimitrios Economou, Constantine Economou et John Marangozis, « Norbornadiene-quadricyclane system in the photochemical conversion and storage of solar energy », Industrial & Engineering Chemistry Process Design and Development, vol. 22, no 4, , p. 627-633 (DOI 10.1021/i300012a021, lire en ligne)
-
(en) Patrick Lorenz, Tobias Luchs et Andreas Hirsch, « Molecular Solar Thermal Batteries through Combination of Magnetic Nanoparticle Catalysts et Tailored Norbornadiene Photoswitches », Chemistry, vol. 27, no 15, , p. 4993-5002 (PMID 33449419, PMCID 7986914, DOI 10.1002/chem.202005427, lire en ligne
 )
) - (en) R. C. Striebich et J. Lawrence, « Thermal decomposition of high-energy density materials at high pressure and temperature », Journal of Analytical and Applied Pyrolysis, vol. 70, no 2, , p. 339-352 (DOI 10.1016/S0165-2370(02)00181-X, lire en ligne)
