Principe de réactivité et de sélectivité
En chimie, le principe de réactivité et de sélectivité est une règle de détermination et d'explication (a posteriori) des produits d'une réaction. Il affirme qu'une molécule ou un intermédiaire réactionnel qui est plus réactif est alors moins sélectif dans les réactions chimiques. Dans ce contexte, la sélectivité correspond au rapport des vitesses de réaction.
Ce principe était largement accepté jusqu'aux années 1970. À cette époque, après la découverte de nombreuses exceptions, ce principe a été considéré comme périmé[1].
L'halogénation radicalaire des alcanes simples se trouve comme exemple de ce principe dans les manuels de chimie organique d'un certain âge : le brome - qui est assez peu réactif - réagit avec le 2-méthylbutane pour former surtout le 2-bromo-2-méthylbutane. Par contre, le chlore - beaucoup plus réactif - réagit avec le même alcane pour former un mélange des quatre isomères de constitution possibles.
Un autre exemple du principe se trouve dans la sélectivité de la réaction de certains carbocations avec l'ion azoture et avec l'eau. Le carbocation très stable triphénylméthyle dérive de la solvolyse du chlorure de triphénylméthyle et réagit 100 fois plus vite avec l'ion azoture qu'avec l'eau. Par contre pour le carbocation tertiaire très réactif de l'adamantane (tel qu'on peut le juger à partir de la vitesse ralentie de la solvolyse), le rapport des réactivités ne correspond qu'à un facteur de 10.
D'autres exemples sont connus où la sélectivité est constante ou bien inversement reliée à la réactivité. Par exemple un groupe des pyridines substituées aux positions 3 et 4 avec une gamme de pKa comme mesure de leurs réactivités démontrent la même sélectivité dans leurs réactions d'alkylation par divers réactifs.
Les premiers succès du principe étaient basés sur des expériences avec des intermédiaires dont les réactivités approchent celle des réactions limitées par la diffusion moléculaire, de sorte que l'intermédiaire le plus réactif paraît réagir plus lentement avec le substrat le plus rapide.
Les relations générales entre la réactivité et la sélectivité aux réactions chimiques peuvent être expliquées par le postulat de Hammond.
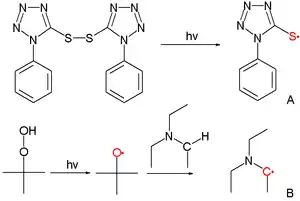
Lorsque les relations entre la réactivité et la sélectivité existent, ils indiques des modes différents de réaction. Une étude[2] a examiné la réactivité des deux espèces de radicaux libres au dessin (A avec radical au soufre, B avec radical au carbone) envers l'addition aux alcènes simples tels que l'acrylonitrile, l'acétate de vinyle et l'acrylamide. Le radical au soufre est plus réactif (6 × 108 vs. 107 M−1 s−1) et moins sélectif (rapport de sélectivité ratio 76 vs. 1200) que le radical au carbone. Dans ce cas l'effet peut être expliqué par le principe de Bell–Evans–Polanyi avec un facteur qui tient compte du transfert de charge des réactifs jusqu'à l'état de transition de la réaction qui peut être estimé par des calculs de la chimie numérique:
où est l'énergie d'activation et est le changement de l'enthalpie associé à la réaction. Pour le radical électrophile au soufre le transfert de charge est le plus grand avec les alcènes riches en électrons tels l'acrylonitrile, mais la réduction conséquente en énergie d'activation (β est negative) est compensée par une enthalpie réduite. Parcontre pour le radical nucléophile au carbone, l'enthalpie ainsi que les effets polaires se renforcent, ce qui agrandit la gamme des énergies d'activation.
Notes et références
- (en)Minireview The Reactivity-Selectivity Principle: An Imperishable Myth in Organic Chemistry Herbert Mayr, Armin R. Ofial Angewandte Chemie International Edition Volume 45, Issue 12 , pages 1844 - 1854 (2006) Abstract
- (en)Search for High Reactivity and Low Selectivity of Radicals toward Double Bonds: The Case of a Tetrazole-Derived Thiyl Radical Jacques Lalevée, Xavier Allonas, and Jean Pierre Fouassier J. Org. Chem.; 2006; 71(26) p. 9723 - 9727 ; (Article) DOI 10.1021/jo061793w
Lien externe
- IUPAC Compendium of Chemical Terminology (Gold Book): Reactivity–selectivity principle



