Potentiel d'électrode
Le potentiel d'électrode , en électrochimie, est la force électromotrice d'une cellule galvanique construite à partir d'une électrode de référence standard et d'une autre électrode à définir[1]. Par convention, l'électrode de référence est l' électrode standard à hydrogène (SHE) définie comme ayant un potentiel de zéro volt. Le potentiel d'électrode peut également être défini comme la différence de potentiel entre les électrodes métalliques chargées et la solution saline.
Le potentiel d'électrode trouve son origine dans la différence de potentiel développée à l'interface entre l'électrode et l' électrolyte . Il est courant de parler de potentiel d'électrode du couple redox M + /M.
Origine et interprétation
Le potentiel d'électrode apparaît à l' interface entre une électrode et un électrolyte en raison du transfert d'éléments chargés à travers l'interface, de l'adsorption spécifique des ions à l'interface et de l'adsorption / orientation spécifique des molécules polaires, y compris celles du solvant.
Dans une cellule électrochimique, la cathode et l'anode ont indépendamment un potentiel d'électrode dont la différence est le potentiel de la cellule :
- E cellule = E cathode − E anode .
Le potentiel d'électrode peut être soit celui à l' équilibre à l'électrode de travail ("potentiel réversible"), soit un potentiel avec une réaction nette non nulle sur l'électrode de travail mais un courant net nul ("potentiel de corrosion", " potentiel mixte "), ou un potentiel avec un courant net non nul sur l'électrode de travail (comme dans la corrosion galvanique ou la voltamétrie ). Les potentiels réversibles peuvent parfois être convertis en potentiel d'électrode standard pour une espèce électro active donnée par extrapolation des valeurs mesurées à l' état standard .
La valeur du potentiel d'électrode en non-équilibre dépend de la nature et de la composition des phases de contact, et de la cinétique des réactions d'électrode à l'interface (Relation de Butler-Volmer).
Une hypothèse opérationnelle pour les déterminations des potentiels d'électrode avec l' électrode standard à hydrogène implique que cette électrode de référence comporte des ions hydrogène dans une solution idéale ayant un « potentiel nul à toutes les températures » de manière équivalente à l' enthalpie standard de formation d'ions hydrogène est « zéro à toutes les températures ».
La mesure
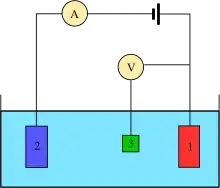
La mesure est généralement effectuée à l'aide d'une configuration à trois électrodes (voir le dessin) :
- électrode de travail ,
- Contre-électrode ,
- Électrode de référence à hydrogène standard ou équivalent).
En cas de courant net non nul sur l'électrode, il est essentiel de minimiser la chute IR ohmique dans l'électrolyte, en positionnant l'électrode de référence près de la surface de l'électrode de travail (voir capillaire de Luggin ) ou à l'aide d'un électrolyte support de conductivité suffisamment élevée. Les mesures de potentiel sont effectuées avec la borne positive de l' électromètre reliée à l'électrode de travail et la borne négative à l'électrode de référence.
Conventions de signes
Historiquement, deux conventions de signe pour le potentiel d'électrode se sont formées [2] :
- convention « Nernst – Lewis – Latimer » (parfois appelée « américaine »),
- convention « Gibbs – Ostwald – Stockholm » (parfois appelée « européenne »).
En 1953 à Stockholm [3] l'IUPAC a reconnu que l'une ou l'autre des conventions est autorisée ; cependant, il a recommandé à l'unanimité que seule la grandeur exprimée selon la convention (2) soit nommée « potentiel d'électrode ». Pour éviter d'éventuelles ambiguïtés, le potentiel d'électrode ainsi défini peut également être appelé « potentiel d'électrode Gibbs-Stockholm » . Dans les deux conventions, l'électrode à hydrogène standard est définie comme ayant un potentiel de 0 V. Les deux conventions s'accordent également sur le signe E pour une réaction à demi-cellule lorsqu'elle est écrite sous forme de réduction.
La principale différence entre les deux conventions [4] est que lors de l'inversion du sens d'une réaction de demi-cellule « comme écrit » , selon la convention (1) le signe E change également, alors que dans la convention (2) ce n'est pas le cas. La logique derrière la commutation du signe E est de maintenir la relation de signe correcte avec le changement d'énergie libre de Gibbs, donnée par Δ G = -nFE où n est le nombre d'électrons impliqués et F est la constante de Faraday . On suppose que la demi-réaction est équilibrée par la demi-réaction SHE appropriée. Étant donné que Δ G change de signe lorsqu'une réaction est écrite à l'envers, les partisans de la convention (1) soutiennent le signe E . Les partisans de la convention (2) soutiennent que tous les potentiels d'électrode rapportés doivent être cohérents avec le signe électrostatique de la différence de potentiel relative.
Différence de potentiel d'une cellule assemblée de deux électrodes
Le potentiel d'une cellule composée de deux électrodes peut être déterminé à partir des potentiels de deux électrodes individuelles en utilisant la formule : Δ V cellule = E rouge, cathode − E rouge, anode ou équivalent,
- Δ V cellule = E rouge,cathode + E oxy,anode .
La définition IUPAC de la différence de potentiel électrique d'une cellule galvanique[5], définit que la différence de potentiel électrique d'une cellule est la différence des potentiels des électrodes à droite et à gauche de la cellule galvanique. Lorsque ΔV cellule est positive, une charge électrique positive traverse la cellule de l'électrode gauche ( anode ) à l'électrode droite ( cathode ).
Articles connexes
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Electrode potential » (voir la liste des auteurs).
- IUPAC, (en) « electrode potential, E », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8).
- C.A. Hamel, "The Encyclopedia of Electrochemistry", Reinhold Publishing Corporation, New York-Chapman & Hall Ltd., London, 1964, p. 429–431.
- (de)P. van Rysselberghe, "Bericht der Kommission für electrochemische Nomenklatur und Definitionen", Z. Electrochem., 58 (1954), p. 530–535.
- Anson, Fred C. "Common sources of confusion; Electrode Sign Conventions," J. Chem. Educ., 1959, 36, p. 394.
- (en) « electric potential difference, ΔV of a galvanic cell », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8).