Potentiel Galvani
Le potentiel Galvani ou potentiel interne, généralement noté φ, est la différence de potentiel électrostatique entre l’intérieur d'un conducteur et le vide. Le potentiel de Galvani doit son nom à Luigi Galvani. Contrairement au potentiel Volta, il n'est pas accessible expérimentalement.
Description
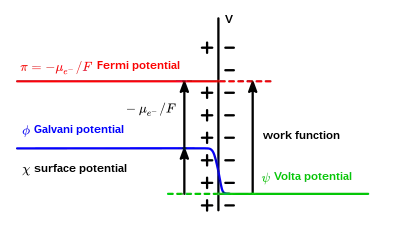
En électrochimie, le potentiel de Galvani (ou potentiel interne) indique la différence de potentiel électrique entre deux points situés dans la masse de deux phases[1]. Ces phases peuvent être constituées par deux solides différents (par exemple, deux métaux en contact) ou un solide et un liquide (par exemple, une électrode métallique immergée dans une solution électrolytique).
Bien qu'il soit souvent appelé « potentiel de Galvani », il s'agit en fait d'une différence de potentiel. Il est donc plus approprié de l'appeler « différence de potentiel de Galvani » ou « différence de potentiel interne ».
En général, la différence de potentiel de Galvani ne peut être mesurée que pour deux phases qui ont la même composition chimique[2].
Potentiel Galvani entre deux métaux
Lorsque deux métaux sont électriquement isolés l'un de l'autre, une différence de tension arbitraire peut exister entre eux. Toutefois, lorsque deux métaux différents sont mis en contact électronique, les électrons circulent du métal ayant une tension plus faible vers le métal ayant une tension plus élevée jusqu'à ce que le niveau de Fermi des électrons dans la masse des deux phases soit égal. Le nombre réel d'électrons qui passent entre les deux phases est faible (il dépend de la capacité entre les objets) et les occupations des bandes électroniques ne sont pratiquement pas affectées. Cette petite augmentation ou diminution de la charge entraîne un déplacement de tous les niveaux d'énergie dans les métaux. Une double couche électrique se forme à l'interface entre les deux phases[3].
L'égalité du potentiel électrochimique entre les deux phases différentes en contact peut s'écrire comme suit :
où:
- est le potentiel électrochimique
- j désigne les espèces qui sont le support du courant électrique dans le système (qui sont des électrons dans les métaux)
- (1) et (2) désignent respectivement la phase 1 et la phase 2.
Or, le potentiel électrochimique d'une espèce est défini comme la somme de son potentiel chimique et du potentiel électrostatique local :
où :
- μ est le potentiel chimique.
- z est la charge électrique portée par un seul porteur de charge (unité pour les électrons).
- F est la constante de Faraday.
- Φ est le potentiel électrostatique
À partir des deux équations ci-dessus :
où la différence du côté gauche est la différence de potentiel de Galvani entre les phases (1) et (2). Ainsi, la différence de potentiel de Galvani est entièrement déterminée par la différence chimique des deux phases, plus précisément par la différence de potentiel chimique des porteurs de charge dans les deux phases.
La différence de potentiel de Galvani entre une électrode et un électrolyte (ou entre deux autres phases électriquement conductrices) se forme de manière analogue, bien que les potentiels chimiques dans l'équation ci-dessus puissent devoir inclure toutes les espèces impliquées dans la réaction électrochimique à l'interface.
Relation avec le potentiel cellulaire mesuré
La différence de potentiel de Galvani n'est pas directement mesurable à l'aide de voltmètres. La différence de potentiel mesurée entre deux électrodes métalliques assemblées dans une cellule n'est pas égale à la différence des potentiels de Galvani des deux métaux (ou à leur combinaison avec le potentiel de Galvani de la solution) car la cellule doit contenir une autre interface métal-métal, comme dans le schéma d'une cellule galvanique :
- M(1) | S | M(2) | M(1)'
où:
- M(1) and M(2)sont les deux métaux différents,
- S désigne l'électrolyte,
- M(1)'est le métal supplémentaire (ici supposé être le métal (1)) qui doit être inséré dans le circuit pour le fermer,
- la barre verticale, |, dénote une frontière de phase.
Le potentiel cellulaire mesuré peut être écrit comme suit[4]:
où :
- E est le potentiel d'une seule électrode,
- (S) désigne la solution d'électrolyte.
D'après l'équation ci-dessus, deux métaux en contact électronique (c'est-à-dire en équilibre électronique) doivent avoir le même potentiel d'électrode[4]. Aussi, les potentiels électrochimiques des électrons à l'intérieur des deux métaux seront les mêmes. Cependant, leurs potentiels de Galvani seront différents (sauf si les métaux sont identiques).
En outre, si l'on définit,le potentiel électrique ou potentiel électromoteur [6]), comme
- ,
qui est le négatif du potentiel électrochimique réduit des électrons, donné en unités de volts. Il est à noter que[5] - [6]ce que l'on mesure expérimentalement en utilisant une sonde métallique inerte et un voltmètre est .
Articles connexes
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Galvani potential » (voir la liste des auteurs).
- (it) « Definizione di potenziale Galvani secondo lo IUPAC Gold Book. »,
- (en)Collected Works of J. Willard Gibbs, Vol. 1 Thermodynamics" (New Haven: Yale University Press, 1906) p. 429.
- (en)V.S. Bagotsky, "Fundamentals of Electrochemistry", Willey Interscience, 2006.
- S. Trasatti, « The absolute electrode potential: an explanatory note (Recommendations 1986) », Pure and Applied Chemistry, vol. 58, no 7, , p. 955–966 (DOI 10.1351/pac198658070955, S2CID 31768829).
- Anil V. Virkar, « Mechanism of oxygen electrode delamination in solid oxide electrolyzer cells », International Journal of Hydrogen Energy, vol. 35, no 18, , p. 9527–9543 (DOI 10.1016/j.ijhydene.2010.06.058)
- (en) Torben Jacobsen et Mogens Mogensen, « The Course of Oxygen Partial Pressure and Electric Potentials across an Oxide Electrolyte Cell », ECS Transactions, vol. 13, no 26, , p. 259–273 (ISSN 1938-6737, DOI 10.1149/1.3050398, Bibcode 2008ECSTr..13z.259J, S2CID 97315796, lire en ligne).









