Interface entre deux électrolytes immiscibles
L'interface liquide/liquide entre deux électrolytes immiscibles est une zone d'intérêt en électrochimie. Dans la littérature scientifique, elle est appelée ITIES, qui est l'acronyme anglais de "Interface between Two Immiscible Electrolyte Solutions"[1] - [2] - [3].
Typiquement, l'un des électrolytes est une solution aqueuse contenant des ions hydrophiles (Na+ et Cl− par exemple) dissous en solution, et l'autre électrolyte est un solvant organique (tels le nitrobenzène ou le 1,2-dichloroéthane) dans lequel sont dissous des ions lipophiles, comme le tétrabutylammonium (en) ou le tétraphénylborane (en). Une ITIES est une interface électrochimique qui est soit polarisée, soit polarisable. Une ITIES est dite polarisable si l'on peut changer son potentiel Galvani (la différence de potentiel électrochimique entre les deux phases adjacentes) sans changer significativement la composition chimique des différentes phases (i.e. sans que des réactions chimiques significatives aient lieu). Une interface entre deux électrolytes immiscibles est dite polarisée si la distribution des espèces chargées et des espèces électroactives entre les deux phases détermine la différence de potentiel Galvani entre les deux phases.
Réactions de transfert de charge à l'interface
Trois catégories générales de transferts de charge peuvent être étudiées à une interface de type ITIES :
- Les réactions de transfert d'ion
- Les réactions de transfert d'ion assistées
- Les réactions de transfert d'électrons hétérogènes
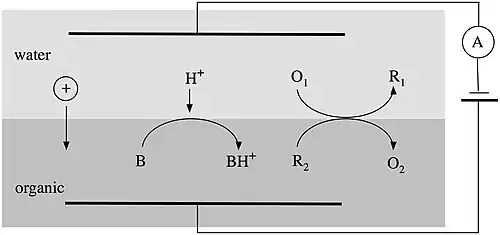
L'équation de Nernst écrite pour une réaction de transfert d'ion est la suivante :
- ,
où est le potentiel de transfert standard défini comme étant l'énergie de Gibbs de transfert exprimée en volts :
L'équation de Nernst pour la réaction de transfert hétérogène d'un électron est la suivante :
- ,
où est le potentiel rédox standard pour un transfert interfacial d'électrons, défini par rapport à l'Électrode standard à hydrogène.
Montage à quatre électrodes
Afin d'étudier le transfert de charge à une interface de type ITIES, un montage à quatre électrodes est nécessaire.
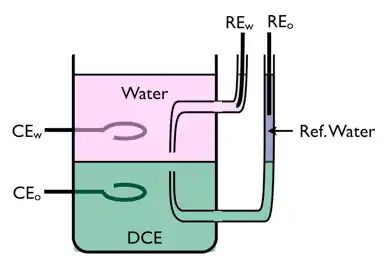
Deux électrodes de référence (RE) sont utilisées pour contrôler la polarisation de l'interface, et deux contre-électrodes (CE) en métal noble permettent de faire circuler le courant. Afin d'éviter tout flux d'ions en courant nul, les ions en solution aqueuse doivent être hydrophiles tandis que les ions en phase organique doivent être lipophiles. Un exemple d'électrolyte hydrophile est le chlorure de lithium, et un exemple d'électrolyte organique est le tétraphénylammonium de tétra-pentafluorophénylborane.
Coefficient de partage des ions
À l'inverse d'un soluté neutre, le coefficient de partage d'un ion dépend de la différence de potentiel Galvani entre les deux phases :
Potentiel interfacial
Lorsqu'un même sel est distribué entre les deux phases, la différence de potentiel Galvani crée une différence de potentiel interfacial qui, pour deux ions C+ et A−, s'écrit :
où γ est l'activité des ions concernés.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « ITIES » (voir la liste des auteurs).
- Le Quoc Hung, « Electrochemical properties of the interface between two immiscible electrolyte solutions: Part I. Equilibrium situation and galvani potential difference », Journal of Electroanalytical Chemistry, vol. 115, no 2, , p. 159–174 (ISSN 0022-0728, DOI 10.1016/S0022-0728(80)80323-8, lire en ligne, consulté le )
- Le Quoc Hung, « Electrochemical properties of the interface between two immiscible electrolyte solutions: Part III. The general case of the galvani potential difference at the interface and of the distribution of an arbitrary number of components interacting in both phases », Journal of Electroanalytical Chemistry, vol. 149, nos 1–2, , p. 1–14 (ISSN 0022-0728, DOI 10.1016/S0022-0728(83)80553-1, lire en ligne, consulté le )
- Zdenek Samec, « Electrical double layer at the interface between two immiscible electrolyte solutions », Chemical Reviews, vol. 88, no 4, , p. 617–632 (DOI 10.1021/cr00086a003)





![{\displaystyle \Delta _{\text{o}}^{\text{w}}\phi _{\text{ET}}^{\ominus }=\left[E_{{\text{O}}_{2}/{\text{R}}_{2}}^{\ominus }\right]_{\text{SHE}}^{\text{o}}-\left[E_{{\text{O}}_{1}/{\text{R}}_{1}}^{\ominus }\right]_{\text{SHE}}^{\text{w}}}](https://img.franco.wiki/i/d4898078bd6d79795352cb3d42be22314081775a.svg)
![{\displaystyle P_{i}={\frac {a_{i}^{\text{o}}}{a_{i}^{\text{w}}}}=\exp \left[{\frac {z_{i}F}{RT}}(\Delta _{\text{o}}^{\text{w}}\phi -\Delta _{\text{o}}^{\text{w}}\phi _{i}^{\ominus })\right]=P_{i}^{\ominus }\exp \left[{\frac {z_{i}F}{RT}}\Delta _{\text{o}}^{\text{w}}\phi \right]}](https://img.franco.wiki/i/cf1a87afec88692b29566f6d3d7a847bcc8225ba.svg)
