Potentiel Volta
Le potentiel Volta (également appelé différence de potentiel Volta, différence de potentiel de contact, différence de potentiel externe, Δψ, ou "delta psi") en électrochimie, est la différence de potentiel électrostatique entre deux métaux (ou un métal et un électrolyte ) qui sont en contact et sont en équilibre thermodynamique . Plus précisément, il s'agit de la différence de potentiel entre un point proche de la surface du premier métal et un point proche de la surface du second métal (ou électrolyte )[1].
Le « potentiel Volta » doit son nom à Alessandro Volta .
Potentiel Volta entre deux métaux

Lorsque deux métaux sont électriquement isolés l'un de l'autre, une différence de potentiel arbitraire peut exister entre eux. Cependant, lorsque deux surfaces métalliques neutres différentes sont mises en contact électrique (même indirectement, à travers un long fil électroconducteur par exemple), les électrons s'écouleront du métal avec le niveau de Fermi le plus élevé vers le métal avec le niveau de Fermi inférieur jusqu'à ce que les deux niveaux, dans les deux phases s'équilibrent (équilibre thermodynamique) (le nombre réel d'électrons qui passent entre les deux phases est généralement faible). Cependant, ce n'est pas parce que les niveaux de Fermi sont égaux que les potentiels électriques sont égaux. Le potentiel électrique à l'extérieur de chaque matériau est contrôlé par sa fonction de travail, et ainsi même à l'équilibre, des métaux différents peuvent montrer une différence de potentiel électrique .
Le potentiel Volta n'est pas une propriété intrinsèque des deux métaux considérés, mais est déterminé par les différences de travail entre les surfaces des métaux. Tout comme la fonction de travail, le potentiel Volta dépend sensiblement de l'état de surface et de la contamination, entre-autres.
Mesure du potentiel Volta (sonde Kelvin)
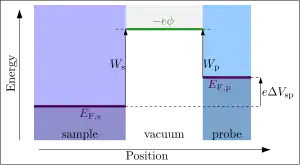
Le potentiel Volta peut être important (de l'ordre de 1 volt) mais il ne peut pas être mesuré directement par un voltmètre ordinaire. Un voltmètre ne mesure pas les potentiels électrostatiques du vide, mais plutôt la différence de niveau de Fermi entre les deux matériaux, une différence qui est nulle à l'équilibre.
Le potentiel Volta correspond à un champ électrique réel dans les espaces entre et autour des deux objets métalliques, champ généré par l'accumulation de charges à leurs surfaces. La charge totale sur la surface de chaque objet dépend de la capacité entre les deux objets, par la relation , où est le potentiel Volta. Il s'ensuit donc que la valeur du potentiel peut être mesurée en faisant varier la capacité entre les matériaux d'une quantité connue (par exemple, en éloignant les objets les uns des autres) et en mesurant la charge déplacée qui traverse le fil qui les relie.
La différence de potentiel Volta entre un métal et un électrolyte peut être mesurée de la même manière[2]. Le potentiel Volta d'une surface métallique peut être cartographié à très petite échelle à l'aide d'un microscope à force à sonde Kelvin, basé sur la microscopie à force atomique . Sur de plus grandes surfaces de l'ordre de millimètres à centimètres, une sonde Kelvin à balayage (SKP), qui utilise une sonde filaire d'une taille de dizaines à centaines de microns, peut être utilisée. Dans les deux cas, le changement de capacité n'est pas connu - à la place, une tension continue de compensation est ajoutée pour annuler le potentiel Volta afin qu'aucun courant ne soit induit par le changement de capacité. Cette tension de compensation est le négatif du potentiel Volta.
Artickes connexes
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Volta potential » (voir la liste des auteurs).
- IUPAC Gold Book, definition of contact (Volta) potential difference.
- V.S. Bagotsky, "Fundamentals of Electrochemistry", Willey Interscience, 2006.



