Cinétique électrochimique
La cinétique électrochimique s'intéresse à l'étude de la vitesse des réactions électrochimiques. Une réaction électrochimique est une réaction d'oxydo-réduction inter faciale : la réaction a lieu à l'interface entre une électrode et un électrolyte. Deux processus complémentaires interviennent dans la réaction électrochimique :
- le transfert électronique entre l'électrode et l'électrolyte
- le transport de matière de ces espèces redox du sein de la solution jusqu'à la surface de l'électrode : ce transport peut avoir lieu par diffusion, convection et migration
Concepts de base
En première approche on peut traiter une étape élémentaire de transfert de charge en suivant le modèle de Butler-Volmer que l'on doit à John Alfred Valentine Butler et à Max Volmer. La loi de vitesse est donné par la relation de Butler-Volmer :
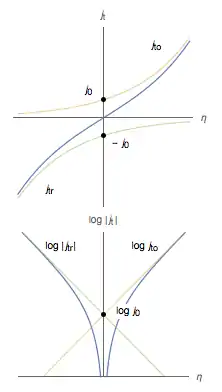
Cette équation donne une densité de courant négative pour une réaction de réduction (surtension négative) et une densité de courant positive pour une réaction d'oxydation (surtension positive), le signe de la densité de courant n'a pas de sens physique et est défini par une convention internationale.
Expression simple des constantes de vitesse
On étudiera les bases de la cinétique électrochimique au travers l'exemple d'une réaction d'oxydoréduction simple c’est-à-dire dont le mécanisme comporte une seule étape :
- R ⇌ O + n e−
- R est le réducteur
- O est l'oxydant.
On notera v la vitesse de cette étape réactionnelle.
et représentent respectivement la concentration en forme réduite et en forme oxydée dans la solution. On notera qu'en cinétique électrochimique, ces concentrations s'expriment traditionnellement en mol⋅cm−3 et non pas en mol⋅L−1 comme dans le Système international d'unités.
et sont les constantes de vitesse de l'étape réactionnelle, respectivement dans le sens de l'oxydation et de la réduction. Comme en cinétique chimique, ces constantes de vitesse varient en fonction de la température. Cependant, en électrochimie, elles dépendent également de la tension d'électrode :
Avec :
- et
où F est la constante de Faraday, Na le nombre d'Avogadro, e la charge de l'électron, kB la constante de Boltzmann et T la température (en kelvins).
Les coefficients ou sont nommés facteurs de symétrie de transfert électronique, respectivement dans le sens de la réduction et de l'oxydation. De même, et sont appelés paramètres cinétiques de transfert.
Constantes de vitesse et de phases adsorbées
Les mécanismes réactionnels en électrochimie présentent souvent des étapes faisant intervenir des espèces adsorbées (adatomes) à la surface de l'électrode. On peut citer par exemple le mécanisme Volmer-Heyrovsky de réduction du proton H+ :
- Etape de Volmer : H+ + s + e− → H,s
- Etape d'Heyrovsky : H+ + H,s + e− → H2 + s
où s représente alors un site libre d'adsorbat à la surface de l'électrode et H,s un atome adsorbé d'hydrogène.
Dans ce type de configuration, les constantes de vitesse ne dépendent plus uniquement de la tension d'électrode et de la température. Elles dépendent également d'éventuelles interactions entre espèces de la phase adsorbée.
Cependant, on se place souvent dans le cadre de l'hypothèse simplificatrice de l'isotherme d'adsorption de Langmuir : la phase adsorbée est alors considérée comme idéale. L'expression des constantes de vitesse ne dépend alors que de la tension d'électrode E(t) et de la température.
Cependant, en ce qui concerne les concentrations des espèces en phase adsorbée, ce ne sont plus évidemment des concentrations volumiques qui entrent en jeu mais des concentrations surfaciques exprimées en mol⋅cm−2.
On exprime une concentration en espèce adsorbée sous la forme d'un produit :
où représente le nombre total de sites surfaciques disponibles pour l'atome X et la fraction de ces sites occupés par l'atome X. est appelé taux de recouvrement de l'espèce X. On a alors :
- ;
- .
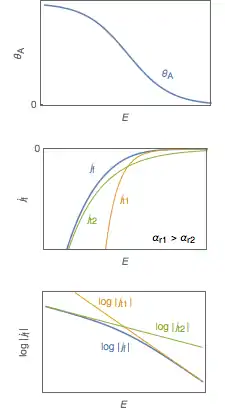
Deux courants limites et peuvent être définis pour la réaction de Volmer-Keyrovsky avec : où .
La densité de courant est donnée par
avec .
À l'inverse, si l'on souhaite prendre en compte les interactions en phase adsorbée, l'hypothèse de l'isotherme d'adsorption de Frumkim introduit alors un paramètre g décrivant ces interactions. Si g est positif, il y a des interactions répulsives entre espèces adsorbées. Inversement, si g est négatif, ces interactions sont attractives. L'expression des constantes de vitesse doit être multipliée par
pour une étape de désorption et par
pour une étape d'adsorption. Le facteur de symétrie de transfert électronique est pris égale à ou selon que cette étape est respectivement une étape d'oxydation ou de réduction.
Études en régime stationnaire
On se situe en régime stationnaire lorsque la tension, le courant et la concentration des espèces en solution ne varient pas au cours du temps. Un état stationnaire ne représente pas nécessairement une situation d'équilibre. Les études de cinétique électrochimique en régime stationnaire ont souvent lieu sur une électrode à disque tournant ou EDT.
Voir aussi
Sources
- Électrochimie - Principes, méthodes et applications, A.J. Bard, L.R. Faulkner, Éditions Masson, 1983.
- Cinétique électrochimique, J.-P. DIARD, B. LE GORREC et C. MONTELLA, Éditions HERMANN, 1996.
- Cellules électrochimiques :aspects thermodynamiques et cinétiques, Didier Devilliers et Éric Mahé, L’actualité chimique - - Article en ligne. (fr) .
![{\displaystyle j_{\text{t}}=j_{0}\left\{\exp \left[{\frac {(1-\alpha )z\mathrm {F} }{\mathrm {R} \mathrm {T} }}\eta \right]-\exp \left[-{\frac {\alpha z\mathrm {F} }{\mathrm {R} \mathrm {T} }}\eta \right]\right\},\;\eta =\mathrm {E} -\mathrm {E_{eq}} }](https://img.franco.wiki/i/c589e6df847388e423b65d24cef05d1bcf237335.svg)
-K_{\text{r}}(t)[O](t)}](https://img.franco.wiki/i/32420771983be742cca84f7196e10357583e891e.svg)
![{\displaystyle [R]}](https://img.franco.wiki/i/131ca25b1a7ce46aec6c01f4303f155cba816027.svg)
![{\displaystyle [O]}](https://img.franco.wiki/i/00fb764ab0c87fa1f3bda798f3fbf1f61018e32f.svg)



















![{\displaystyle j_{\text{t1}}=-2\,F\,\Gamma \,K_{\text{r1}}\,[H^{+}],\;j_{\text{t2}}=-2\,F\,\Gamma \,K_{\text{r2}}[H^{+}]}](https://img.franco.wiki/i/9821b05b5560e259c1382b72464be4fd96a086eb.svg)

![{\displaystyle j_{\text{f}}=-{\frac {2\,F\,\Gamma \,K_{\text{r1}}\,K_{\text{r2}}\,[H^{+}]}{K_{\text{r1}}+K_{\text{r2}}}}}](https://img.franco.wiki/i/1c046d1cad5272745fdea6277f347e2d4f7aef72.svg)



