Paralysie flasque aiguë
La paralysie flasque aiguë (ou PFA ou myélite flasque aiguë ou paralysie avec myélite antérieure ou syndrome de pseudo-polio[1]) est un syndrome (neurologique) rare mais grave[2], caractérisé par une inflammation aiguë des cellules de la corne de la moelle spinale (substance grise). Une faiblesse des extrémités, généralement asymétrique, avec une prédominance proximale apparait brutalement et se développe en moins de quatre jours. Le tonus musculaire diminue, jusqu'à une totale flascidité du bras ou de la jambe souvent. Les réflexes ostéotendineux profonds disparaissent sur les membres ou extrémités touchés. Des symptômes bulbaires peuvent survenir, mais l'état mental, les sensations et que les fonctions vésicale et intestinale sont généralement préservées.
| MedlinePlus | 007743 |
|---|---|
| MeSH | C000629404 |
![]() Mise en garde médicale
Mise en garde médicale
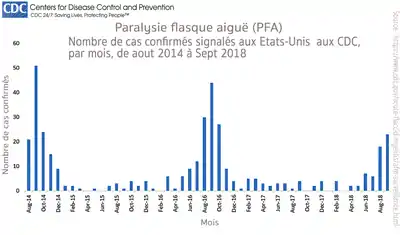
Ce syndrome semble ne toucher que des enfants, adolescents ou très jeunes adultes. La maladie n’est pas nouvelle[2], mais son incidence s’est fortement accrue depuis 2014 au moins[3], ce qui semble être nouveau[2] ; une forte augmentation de l'incidence de ce syndrome aux États-Unis en 2014 a conduit à la définition de ce nouveau terme (« Acute flaccid myelitis » ou AFM pour les anglophones).
Un prodrome viral est généralement associé. La vague de 2014 a coïncidé avec une hausse des maladies provoquées par l'entérovirus 68, membre du genre Enterovirus (et donc lié au poliovirus). Cependant une étude effectuée auprès d'environ 70 personnes atteintes de la maladie n'a révélé la présence de l'EV-D68 qu'une seule fois dans le liquide cérébrospinal. Un autre entérovirus EV-A71 a été retrouvé chez un malade[4]. De plus, il n'y a pas eu de pic de maladie causée par EV-68 en 2016. Un cas a été signalé qui pourrait être causé par un nouvel entérovirus C105 (découvert en 2010 chez deux patients, péruvien et congolais, ce qui laisse penser qu’il s’agit d’un virus à large répartition[5] - [6], actuellement difficile à détecter en laboratoire[7]. En 2019, une étude prouve l'implication d'entérovirus non-polio dans la maladie[8].
Une évaluation rapide est essentielle pour différencier la myélite flasque aiguë des autres causes traitables de la paralysie flasque aiguë, car des traitements éprouvés existent pour d'autres troubles.
Il n’existe ni vaccin ni traitement dédié. Une thérapie de soutien et une neurorééducation sont essentielles à la gestion de la PFA ; divers traitements immunomodulateurs ont été tentés mais sans efficacité démontrée. Les résultats à long terme varient considérablement (de la guérison à tétraplégie avec éventuel besoin d’une assistance respiratoire)[9]. À ce jour la majorité des enfants touchés ne récupèrent que partiellement leur motricité et semblent devoir supporter une invalidité définitive[9].
Situation en 2018
Les données concernant ce syndrome et son extension récente sont provisoires et ne doivent pas être considérées comme médicalement et scientifiquement définitives.
- En 2018, il n’y a pas de traitement disponible contre ce syndrome ou contre le micro-organisme qui pourrait éventuellement en être la cause.
- La maladie reste très rare (moins de 1 cas par million d’américains) mais en croissance avec des pics épidémiologiques en 2014, 2016 et 2018, toujours en fin d’été ou en automne. De l’été 2014 à mi , 386 cas ont été confirmés par les CDC américains (enfants et adolescents de moins de 18 ans dans 90 % des cas avec un âge moyen proche de 4 ans[10]. Le nombre réel de cas est sans doute sous-estimé, la maladie pouvant être confondue avec d’autres cas de paralysies flasques.
En Europe en 2016 un rapport décrit 29 cas (dans 12 pays) de « myélite flasque aiguë » associés à l'Entérovirus D68, également survenus en fin d’été ou en automne (le virus n’était présent dans le liquide cérébrospinal que chez 2 de ces patients)[11], y compris dans le Nord de l’Europe, en Norvège[12], précisant que ces cas que « ceux-ci ne représentent probablement que la partie visible de l’iceberg »[13].
Signes et symptômes
Les symptômes de la PFA incluent :
- difficulté à bouger les yeux et/ou paupières tombantes ;
- affaissement et/ou affaissement des traits du visage ;
- difficulté à avaler et/ou difficulté d’élocution ;
- faiblesse soudaine d’un bras ou d’une jambe[14].
Les Centres pour le contrôle et la prévention des maladies (CDC) des États-Unis ont publié un premier résumé sur cette affection dans le cadre d'un avis de santé daté du [15]:
En 2014 le CDPHE (Hôpital pour enfants du Colorado) et les CDC ont étudié neuf cas de maladie neurologique aiguë chez des patients identifiés du au , âgés de 1 à 18 ans (âge médian 10 ans). La plupart étaient originaires de la région métropolitaine de Denver. Tous ont été hospitalisés. Les caractéristiques communes incluaient une faiblesse focale aiguë d’un membre et des résultats spécifiques sur l'imagerie par résonance magnétique (IRM) de la moelle épinière consistant en des lésions non-rehaussantes largement limitées à la matière grise (partie interne de la moelle épinière). Dans la plupart des cas, ces lésions couvraient plus d'un niveau de la moelle épinière. Certains présentaient également un dysfonctionnement aigu du nerf crânien avec corrélation en IRM des lésions du tronc cérébral non amplifiées. Aucun de ces enfants n’a présenté d’état mental altéré ni de convulsions. Aucun ne présentait de lésions corticales, sous-corticales, ganglionnaires de la base ou thalamiques à l’IRM. La plupart avaient contracté une maladie respiratoire fébrile au cours des deux semaines précédant l'apparition de symptômes neurologiques. Dans la plupart des cas, les analyses du liquide cérébrospinal (LCS) ont révélé une pléocytose légère à modérée (augmentation du nombre de cellules dans le LCS compatible avec un processus inflammatoire ou infectieux.
Le CDC a demandé aux médecins américains de faire remonter des informations à propos de tous les cas répondant à quatre critères : patients diagnostiqués après le , âgés de 21 ans maximum, montrant une faiblesse aiguë d’un membre, avec lésion de la moelle épinière largement limitée à la matière grise visualisée par IRM[15] - [16].
Au Texas un groupe a déclaré avoir observé en 2013 une tendance d'un à quatre cas par an présentant des caractéristiques similaires à celles de la poliomyélite[17].
Le rapport hebdomadaire des CDC sur la morbidité et la mortalité[18] et une téléconférence des CDC, de sensibilisation et de communication vers des cliniciens[19] ont indiqué que de nombreux cas présentaient aussi des douleurs au cou, au dos ou aux extrémités, mais que les personnes touchées conservaient généralement des sensations normales au niveau des membres[20]. Quelques participants à cette téléconférence ont discuté de la question de savoir si ces douleurs, qui s'estomperont plus tard, pourrait précéder le début de la paralysie[19] - [21].
Un rapport du [16] décrivait des signalements en Californie et dans le Colorado (État), suggérant que le nombre de cas récents pourrait être de 100 ou plus pour tous les États-Unis. Le diagnostic de ces cas comprenait de bons antécédents médicaux, une imagerie par IRM et l'élimination de la myélite transverse ou du syndrome de Guillain-Barré en tant que causes potentielles. Les médecins utilisaient une liste de diffusion en ligne sur le serveur de liste pour communiquer sur des cas similaires en Alabama et au Kansas. Le plus grand cluster signalé l’a été au Colorado, avec un total de 29 cas (dont 12 signalés à partir d')[16].
Trois cas sur quatre traités en Alabama impliquaient une incapacité totale de bouger un bras, faisant évoquant une lésion nerveuse périphérique : tous sont survenus après et ils se ressemblaient vraiment, toujours sans changement d'état mental, avec des IRM très similaires (pouvant presque se superposer et montrant une implication de la matière grise). Le bras levé par le médecin tombait littéralement une fois lâché, avec une sensation généralement intacte. L’examen sensoriel était néanmoins moins précis que pour un adulte car il s’agissait de jeunes enfants)[16]. Les médecins du Children's Mercy Hospital précisent que les IRM montraient tous — uniformément — une augmentation du signal dans les cornes ventrales de la moelle épinière, précisément dans la même région de la moelle épinière que celle qui est touchée par la polio… le taux de globules blancs était anormalement élevé dans le liquide cérébrospinal de presque tous les patients dont certains présentaient aussi des découvertes du tronc cérébral et du nerf crânien, comme dans le cas de la poliomyélite. Ce syndrome était antérieurement rarissime[16].
Une session extraordinaire s’est tenue le lors d'une réunion annuelle de la Child neurology society (CNS) où un vote à main levée donnait à penser que les 250 participants avaient a eux-seuls traité collectivement plus d'une centaine de cas. Un tiers des participants avaient vu un cas récent, mais seuls deux mains se sont levées quand on leur a demandé s'ils avaient assisté à un rétablissement complet.
Un hôpital de Philadelphie avait reçu au moins 10 cas (à ce moment le nombre total de cas confirmés aux CDC n’était que de 51). Un membre de l’école de médecine de l'université Stanford a suggéré que le nombre réel de cas était très sous-estimé : « Il y a quelques semaines, j’ai participé à une conférence téléphonique avec environ 50 médecins de centres médicaux de l’Amérique du Nord. Chaque centre avait vu un ou plusieurs cas récents. Cela a fait monté les chiffres très haut et très vite » a-t-il expliqué, notant aussi que « le nombre de personnes touchées était alors encore bien inférieur aux dizaines de milliers de personnes touchées par la saison de la polio. Heureusement, comme pour la poliomyélite, le nombre de cas semblait diminuer avec l'arrivée du froid[22].
Sur les 64 patients répondant aux critères du CDC, diagnostiqué entre aout et fin , 80% avaient contracté une maladie respiratoire (avec de la fièvre dans 75% des cas) les jours précédant l’apparition de la paralysie flasque des membres, dont l’apparition a généralement été brutale[23] (le maximum de la paralysie est atteint en moins de 4 jours[24]). Le , le nombre de cas confirmés s'élevait à 88 dans 29 États[25].
Causes
.
En , les CDC considèrent que la PFA peut être causée par « une variété de virus, de toxines environnementales et de maladies génétiques », énumérant notamment comme causes potentielles le poliovirus, les entérovirus non-polio, le virus du Nil occidental et des adénovirus[27]. Un an plus tard, la responsabilité des entérovirus non-polio est clairement prouvée par l'analyse sérologique du liquide cérébrospinal de 100 enfants (dont 42 souffrant de PFA)[8].
L'avis de santé du CDC publié décrivant les cas, a été suivi d’une identification de l’entérovirus 68 (ou « EV-D68 » du groupe de l’espèce D des entérovirus[15].
En 2014, tous les tests de LCR ont été négatifs pour le virus du Nil occidental et pour les entérovirus (poliovirus compris).
Les échantillons nasopharyngés étaient positifs pour le rhinovirus / entérovirus (chez six de huit patients testés). Pour six cas positifs, quatre ont été typés EV-D68 et les deux autres sont en attente de résultat. Les tests d'autres échantillons sont toujours en cours. Huit enfants sur neuf ont été confirmés comme étant à jour en matière de vaccination contre la polio. Le vaccin contre la polio ne protègerait donc pas contre ce syndrome. Des enquêtes épidémiologiques et analyses en laboratoire sur ces cas sont en cours.
Les États-Unis ont simultanément connu une épidémie d’EV-D68 à l’échelle nationale, associée à une maladie respiratoire grave. Un lien possible entre le syndrome, d’autres maladies neurologiques et cette grande épidémie d’EV-D68 fait partie de l’enquête en cours. Pour ce travail le CDC recherche des informations sur d’autres maladies neurologiques similaires dans tous les États, en particulier sur des clusters de patients (cas regroupés dans l’espace et le temps) pour mieux caractériser l'épidémiologie et l'étiologie de ce type de cas.
Un rapport du MMWR a souligné la difficulté d'établir un lien de causalité entre le syndrome et un virus de ce type[18] ; des clusters de cas de maladies neurologiques aiguës sont bien apparues sur un fond de détection du virus EV-D68 causant de graves maladies respiratoires dans de nombreuses régions des États-Unis, notamment dans le Colorado. Et la littérature mentionne deux cas de maladie neurologique a priori causée par EV-D68 (paralysie flasque aiguë et encéphalomyélite) car dans ces deux cas l’EV-D68 a été détecté dans le LCS. Cependant compte tenu de la large circulation à cette époque d'infections respiratoires à EV-D68 largement communes (notamment dans le Colorado) et compte tenu de la fréquence d’antécédents de maladie respiratoire chez la plupart de ces enfants, la détection de l'EV-D68 dans des échantillons de voies respiratoires supérieures non stériles chez ceux atteints d'une maladie neurologique pourrait être une coïncidence[18]. Des enquêtes épidémiologiques et de laboratoire ont néanmoins été engagées sur ces cas[18].
Avindra Nath (en), directrice des National Institute of Neurological Disorders and Stroke (Institut national des troubles neurologiques et des accidents cérébrovasculaires) et présidente de la Société internationale de neurovirologie, a comparé la situation actuelle à celle qui prévalait lors des enquêtes épidémiologiques prolongées ayant conduit à confirmer que la VIH était bien la cause du syndrome SIDA. En réponse à la suggestion selon laquelle un entérovirus pourrait jour un rôle similaire à celui de la polio, Nath a déclaré que l’entérovirus 68 était beaucoup moins virulent que le poliovirus et se propageait beaucoup plus lentement que lui et que, contrairement à ce qui se passe avec la polio, seuls quelques cas de paralysie ont été décrits par mille enfants infectés par l’entérovirus 68. Elle a aussi suggéré que les adultes souffrant de maladies respiratoires soient maintenant également évalués pour d’éventuels déficits neurologiques et que les maladies infectieuses soient considérées comme une cause possible quand des patients présentent des symptômes neurologiques[28].
En 2015 Le séquençage métagénomique en profondeur du liquide cérébrospinal d’un groupe de 14 patients atteints de myélite aiguë flasque n'a pas mis en évidence de cause infectieuse autre que l'entérovirus D68 (identifié pour la première fois en 1962, essentiellement connu comme cause de maladie respiratoires, mais dont plusieurs variants sont connus[29]), ce qui plaide pour la responsabilité de cet entérovirus.
En 2016 un rapport décrit 29 cas (dans 12 pays) de « myélite flasque aiguë » associés à l'Entérovirus D68, également survenus en fin d’été ou en automne (le virus n’était présent dans le fluide cérébrospinal que chez 2 de ces patients)[30], y compris dans le nord de l’Europe, en Norvège[31], précisant que ces cas que "ceux-ci ne représentent probablement que la partie visible de l'iceberg"[32].
Diagnostic
La « paralysie flasque aiguë » (ou PFA) est diagnostiquée en examinant le système nerveux du patient et les parties du corps affectées par une faiblesse brusquement apparue (chute du tonus musculaire et des réponses réflexes), sans oublier l'examen des images de la moelle épinière et éventuellement du cerveau par IRM (imagerie par résonance magnétique). Des tests de laboratoire portent sur le liquide céphalo-rachidien (le liquide qui entoure le cerveau et la moelle épinière). La conduction nerveuse (transmission des impulsions) peut aussi être évaluée[33].
Le cerveau peut présenter des anomalies, pouvant être distinguées de celles liées à l’Encéphalomyélite aiguë disséminée aussi dite ADEM (pour Acute disseminated encephalomyelitis)[34]. Les images IRM de 74 jeunes malades étudiées, montrent que le tronc cérébral présente souvent des extensions des lésions de la moelle épinière dans la médulla et les pons. Des lésions supratentorielles ont lors de cette étude été trouvées chez 20 patients du groupe (27 %). Des lésions de la substance blanche sous-corticale touchaient 10 patients (13,5 %), la substance grise corticale présentait des lésions chez 7 des enfants (9,4 %), et des lésions thalamiques étaient visibles chez 6 enfants (8,1 %) alors que des noyaux gris centraux étaient visible chez trois enfants seulement (4 %). 5 présentaient des lésions au cervelet (6,7 % des cas). Contrairement à une idée reçue sur cette maladie l’état mental est parfois perturbé : 16 patients (20 % de ces cas) présentaient une léthargie. Aucun de ces enfants ne présentait de lésion de la substance blanche supratentorielle, qui est typique de l’ADEM n’a été observée. Les auteurs invitent à poser les diagnostics d'ADEM (Acute disseminated encephalomyelitis) avec prudence, surtout pour des cas de paralysie flasque avec lésions longitudinales visibles à l'IRM sur la moelle épinière, survenues à l'automne, lorsque l'incidence de la PFA augmente.
Diagnostic différentiel
Il convient d’éliminer les possibilités suivantes :
- poliomyélite ;
- myélite transverse[35] ;
- syndrome de Guillain-Barré ;
- autres myélopathies inflammatoires ;
- myélopathies ischémiques aiguës.
Tests
Des tests sont nécessaires pour le suivi épidémiologique et le diagnostic.
Steve Oberste, modérateur de la téléconférence du (CDC – COCA) a décrit le test alors en cours sur l'entérovirus D-68 sous la forme d'une amplification générique par PCR de la séquence de l’entérovirus, suivie d’un séquençage pour en déterminer le sérotype. IL a précisé qu’un test de PCR en temps réel - plus rapide et moins laborieux - était aussi en cours de validation[19].
Le CDC a commencé à utiliser ce nouveau test dès le [36].
Prévention
Le rapport CDC MMWR recommande « pour prévenir les infections en général » que les personnes malades restent à leur domicile, se lavent bien et souvent les mains à l’eau savonneuse. Il faut aussi éviter les contacts étroits avec les malades (ex : toucher et serrer la main de malades) et nettoyer et désinfecter les surfaces fréquemment touchées[18]. À la différence de la polio, on ne dispose pas actuellement de vaccin contre la myélite flasque aiguë ni d’aucun traitement connu. On ne sait pas si les stéroïdes sont utiles ou nuisibles[16]. Des techniques telles que la plasmaphérèse, les immunoglobulines intraveineuses et des antiviraux expérimentaux ont été testés à titre expérimental, mais leur efficacité n'a pas été rapportée[17].
Le , le CDC a publié le rapport Considérations provisoires sur la gestion clinique des patients atteints de paralysie flasque aiguë, sur la base des "« directives consensuelles tirées d'experts en maladies infectieuses, neurologie, pédiatrie, médecine de soins intensifs, épidémiologie de santé publique et virologie ». Selon Mark Sawyer (de l'American Academy of Pediatrics) qui a contribué à ce document, et qui est cité dans le bulletin d'information de l’organisation : il n'existe aucune preuve claire que des traitements visant à modifier le système immunitaire (corticostéroïdes, immunoglobuline, plasmaphérèse…) aient quelque effet bénéfique dans le cas de ce syndrome[23]. La plasmaphérèse est même spécifiquement déconseillée car le potentiel de lésion est important en l'absence de toute preuve de bénéfice[23]. Une transplantation de nerfs à partir des côtes et du diaphragme, réalisée dans les 8 à 12 mois suivant le début de la paralysie, a été rapportée[37].
Épidémiologie
La réunion de la Société de neurologie pédiatrique du a étudié la question d’éventuelles rechutes de myélite aiguë flasque l’année suivante ou Das le futur en fin d’été[38].
Les entérovirus D68 et A71 semblent causer des symptômes neurologiques plus souvent que les autres entérovirus, mais ce sont des causes peu fréquentes de rhume[17] - [39].
Une hypothèse est que des entérovirus causent des myélites aiguë flasques à bas taux depuis de nombreuses années, mais qu’elles ont été diagnostiquées à tort comme myélite transverse et que l'entérovirus D68 ait tout simplement été plus répandu en fin d’été et début d’automne 2014 aux États-Unis[17].
Les CDC avaient confirmé 538 cas d'entérovirus D68 infections dans 43 états. Les CDC avaient déterminé et soumis à la GenBank des séquences génomiques complètes ou presque complètes pour trois souches connues du virus, qui sont "génétiquement apparentées aux souches de EV-D68 détectées au cours des années précédentes aux États-Unis, en Europe et en Asie[36] - [40].
Soins
Six enfants sur dix à Denver ont été renvoyés chez eux pour un traitement ambulatoire ; certains présentant des symptômes bénins ont récupéré d'une faiblesse temporaire d'un membre, alors que le sort des personnes les plus gravement atteintes reste incertain. Une physiothérapie intensive et l’ergothérapie peuvent être bénéfiques pour le rétablissement[17] - [41] - [42].
Une greffe de nerfs a été testée chez deux patients, avec un succès modéré deux et trois ans après l’opération[43].
Pas de contagion
Bien que les taux de symptômes de paralysies semblent corrélés au nombre d'infections respiratoires préalables, les cas ne sont pas regroupés au sein de familles, de groupes ou d’écoles. Ce fait suggère que la paralysie en soi n'est pas directement contagieuse, mais qu’elle est une complication très rare d’une infection respiratoire commune (simple rhume peut-être)[17].
Pistes de recherche
En 2017, un modèle animal murin (souris de laboratoire) a été proposé par Hixon & al. [44] pour l’étude de ce syndrome. Sept souches EV-D68 ont été testées pour leur capacité à induire une maladie neurologique chez la souris nouveau-né [44]. Quatre souches EV-D68 échantillonnées lors de l’épidémie de 2014 (sur cinq testées) ont provoqué chez les souris une maladie paralytique proche de la PFM humaines. L’une des souches de 2014, et les souches de Fermon et Rhyne, prototypes de EV-D68, datant de 1962, n’ont pas ou rarement provoqué de paralysie chez la souris[44]. Avec l’une des souches de 2014, des virus infectieux, des particules de virions et de génome viral ont été retrouvés dans la moelle épinière de souris paralysées. La maladie a pu être enclenchée par voie intramusculaire, intracérébrale, intraperitoneale et intranasale, à fréquence décroissante, rapidement associée à une infection et à une perte de motoneurones dans les cornes antérieures des segments de la moelle épinière correspondant aux membres paralysés[44]. Cette étude montre que des sérums immuns EV-D68, mais pas les sérums de souris normaux, protégeaient les souris du développement de la paralysie et de la mort lorsqu’administrées avant le test viral. Ce modèle semble donc pouvoir être utilisé pour la recherche de thérapies[44].
L'entérovirus D68 (EV-D68) injecté par voie intraperitoneale à des souris âgées de dix jours et ne présentant pas de réponse à l’interféron. Une paralysie s'est développée dans les membres postérieurs[45]. Après six semaines de paralysie, les motoneurones étaient lésés ; le virus a été retrouvé dans les muscles jusqu’à la fin de la paralysie, en plus de la présence du virus dans la moelle épinière. 4 autres souris ont été infectées par voie intranasale toujours par l’EV-D68. Deux d’entre elles ont développé une paralysie des membres antérieurs[45]. Dans ces cas les membres affectés présentaient une maladie musculaire, mais aucune infection de la moelle épinière du liquide cérébro-spinal n’était détectée. L’EV-D68 semble donc pouvoir paralyser des muscles sans traces de virus dans la moelle épinière, comme on l’observe le plus souvent chez l’enfant humain infecté[45].
Divers autres travaux de recherche visent à améliorer les tests moléculaires[46] et à préciser les causes du syndrome, proposer des médicaments ou thérapies non-médicamenteuses pertinentes pour soulager les patients ou déboucher sur un éventuel vaccin. Un vaccin ne peut être produit que si plusieurs souches d'entérovirus génétiquement proches causent effectivement une myélite aiguë flasque ; un vaccin pourrait éventuellement ne protéger que contre certaines formes de la maladie[17].
Une association dédiée, Transverse Myelitis Association, a été créée qui soutient la recherche de traitement de la maladie, dont une étude qui en 2018 a conclu que pour les cas d’enfants victimes de la maladie et présentant des signes d'atteinte à la substance blanche, l’utilisation de stéroïdes et/ou un traitement par PLEX semble apporter plus de bénéfices que d’inconvénients, ce qui peut laisser penser que si les dommages causés aux cellules des cornes antérieures par la maladie sont probablement induits par une infection virale, les dommages causés aux motoneurones supérieurs pourraient résulter d’une pathophysiologie de nature inflammatoire (l’un des auteurs signale qu’il a aussi travaillé pour Novartis, Alexion et EMD Serono)[47].
Voir aussi
Articles connexes
Liens externes
Bibliographie
- Ayscue P, Haren KV, Sheriff H, et al. Acute flaccid paralysis with anterior myelitis—California, June 2012–June 2014. MMWR Morb Mortal Wkly Rep 2014; 63: 903–06.
- Dyda, A., Stelzer-Braid, S., Adam, D., Chughtai, A. A., & MacIntyre, C. R. (2018). «The association between acute flaccid myelitis (AFM) and Enterovirus D68 (EV-D68)–what is the evidence for causation ? ». Eurosurveillance, 23(3).
- Gordon‐Lipkin, E., Muñoz, L. S., Klein, J. L., Dean, J., Izbudak, I., & Pardo, C. A. (2018). Comparative quantitative clinical, neuroimaging, and functional profiles in children with acute flaccid myelitis at acute and convalescent stages of disease. Developmental Medicine & Child Neurology (résumé)
- Horner, L. M., Poulter, M. D., Brenton, J. N., & Turner, R. B. (2015). Acute flaccid paralysis associated with novel enterovirus C105. Emerging infectious diseases, 21(10), 1858.
- Lang M, Mirand A, Savy N, et al. Acute flaccid paralysis following enterovirus D68 associated pneumonia, France, 2014. Euro Surveill 2014; 19: pii:20952.
- Marcus, L., & Ness, J. (2018). A Case Series of Acute Flaccid Myelitis in Pediatric Patients (P2. 317)|résumé.
- Messacar K, Schreiner TL, Maloney JA, et al. A cluster of acute flaccid paralysis and cranial nerve dysfunction temporally associated with an outbreak of enterovirus D68 in children in Colorado, USA. Lancet 2015; published Jan 28. http://dx.doi. org/10.1016/S0140-6736(14)62457-0
- Messacar, K., Schreiner, T. L., Van Haren, K., Yang, M., Glaser, C. A., Tyler, K. L., & Dominguez, S. R. (2016). Acute flaccid myelitis: a clinical review of US cases 2012–2015. Annals of neurology, 80(3), 326-338.
- Morris, S., Kim, Y. M., Waubant, E., Van Haren, K., & Mar, S. S. (2017). Acute Flaccid Myelitis. In Pediatric Demyelinating Diseases of the Central Nervous System and Their Mimics (p. 241-250). Springer, Cham (résumé).
- Nelson, G. R., Bonkowsky, J. L., Doll, E., Green, M., Hedlund, G. L., Moore, K. R., & Bale Jr, J. F. (2016). Recognition and management of acute flaccid myelitis in children. Pediatric neurology, 55, 17-21 (résumé).
- Kira R (2018) Acute Flaccid Myelitis. Brain and nerve= Shinkei kenkyu no shinpo, 70(2), 99-112.
- Greninger, A. L., Naccache, S. N., Messacar, K., Clayton, A., Yu, G., Somasekar, S., ... & Messenger, S. (2015). A novel outbreak enterovirus D68 strain associated with acute flaccid myelitis cases in the USA (2012–14): a retrospective cohort study. The Lancet Infectious Diseases, 15(6), 671-682
- Sejvar, J. J., Lopez, A. S., Cortese, M. M., Leshem, E., Pastula, D. M., Miller, L., ... & Fischer, M. (2016). Acute flaccid myelitis in the United States, August–December 2014: results of nationwide surveillance. Clinical Infectious Diseases, 63(6), 737-745.
Références
- Kira R (2018) Acute Flaccid Myelitis. Brain and nerve= Shinkei kenkyu no shinpo, 70(2), 99-112.
- Centres pour le contrôle et la prévention des maladies, Acute flaccid myelitis, (lire en ligne).
- Van Haren, K., Ayscue, P., Waubant, E., Clayton, A., Sheriff, H., Yagi, S., ... & Wadford, D. A. (2015). Acute flaccid myelitis of unknown etiology in California, 2012-2015 | Jama| 314(24), 2663-2671.
- « Édition du soir Ouest France », sur www.ouest-france.fr (consulté le ).
- Novel serotypes 105 and 116 are members of distinct subgroups of human enterovirus C. Lukashev AN, Drexler JF, Kotova VO, Amjaga EN, Reznik VI, Gmyl AP, Grard G, Taty Taty R, Trotsenko OE, Leroy EM, Drosten C J Gen Virol. 2012 Nov; 93(Pt 11):2357-62.
- Mune M. Newly emerging C-105 entovirus genotype in acute respiratory disease in Cuba. In: Proceedings of the 4th World Conference on Virology; 2014 Oct 6–8; San Antonio (Texas), USA. J Antivir Antiretrovir. 2014. p. 206.
- Horner, L. M., Poulter, M. D., Brenton, J. N., & Turner, R. B. (2015). Acute flaccid paralysis associated with novel enterovirus C105. Emerging infectious diseases, 21(10), 1858.
- (en) Ryan D. Schubert, Isobel A. Hawes, Prashanth S. Ramachandran, Akshaya Ramesh, Emily D. Crawford et al., « Pan-viral serology implicates enteroviruses in acute flaccid myelitis », Nature Medicine, vol. 25, , p. 1748-1752 (DOI 10.1038/s41591-019-0613-1).
- Gordon‐Lipkin, E., Muñoz, L. S., Klein, J. L., Dean, J., Izbudak, I. & Pardo, C. A. (2018). Comparative quantitative clinical, neuroimaging, and functional profiles in children with acute flaccid myelitis at acute and convalescent stages of disease. Developmental Medicine & Child Neurology (résumé)
- Portail des CDC américains consacré à la paralysie flasque aiguë
- (en) Knoester, M., Helfferich, J., Poelman, R., Van Leer-Buter, C., Brouwer, O. F., Niesters, H. G., & 2016 EV-D68 AFM Working Group. (2018). « Twenty-Nine Cases of Enterovirus-D68 Associated Acute Flaccid Myelitis in Europe 2016; A Case Series and Epidemiologic Overview ». The Pediatric infectious disease journal.
- (en) Pfeiffer, H. C., Bragstad, K., Skram, M. K., Dahl, H., Knudsen, P. K., Chawla, M. S., ... & Rojahn, A. E. (2015). « Two cases of acute severe flaccid myelitis associated with enterovirus D68 infection in children, Norway, autumn 2014 ». Eurosurveillance, 20(10), 21062.
- (en) Knoester, Marjolein et al. on behalf of the 2016 EV-D68 AFM Working Group, « Twenty-Nine Cases of Enterovirus-D68 Associated Acute Flaccid Myelitis in Europe 2016; A Case Series and Epidemiologic Overview », The Pediatric Infectious Disease Journal, 18 septembre 2018
- « How to Spot Symptoms of Acute Flaccid Myelitis in Your Child Infographic », sur CDC (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public..
Cet article reprend du texte de cette source, qui est dans le domaine public.. - « Acute neurologic illness with focal limb weakness of unknown etiology in children », Centres pour le contrôle et la prévention des maladies, .
- Dan Hurley, « Cases of acute flaccid myelitis in children suspected in multiple states, prompting comparisons to polio », Neurology News, American Academy of Neurology, .
- « An Update on Outbreak of Paralysis in US: Acute Flaccid Myelitis », The transverse myelitis association, (audio)
- « Acute neurologic illness of unknown etiology in children — Colorado, August–September 2014 », CDC, .
- « Neurologic Illness with Limb Weakness in Children », CDC, .
- « Neurologic Deficits in Children Preceded by Febrile Illness », American Academy of Family Physicians, .
- Robert Roos, « Role of EV-D68 in polio-like illnesses still unclear », Center for Infectious Disease Research and Policy, .
- Hurley D (2014). "The mysterious polio-like disease affecting American kids". The Atlantic, 24 oct.
- « CDC releases guidance on acute flaccid myelitis », AAP News (American Academy of Pediatrics), .
- Nelson, G. R., Bonkowsky, J. L., Doll, E., Green, M., Hedlund, G. L., Moore, K. R., & Bale Jr, J. F. (2016). Recognition and management of acute flaccid myelitis in children. Pediatric neurology, 55, 17-21 (résumé).
- « Investigation of Acute Neurologic Illness with Focal Limb Weakness of Unknown Etiology in Children, Fall 2014 », CDC (consulté le ). Remarque : le document disponible à cette URL peut être régulièrement mis à jour, dont le texte "As of November 20, CDC has verified reports of 88 cases in 32 states. We are working with healthcare professionals and state and local officials to investigate all of these cases. We are also in the process of verifying less than half a dozen additional reports. »
- Josefina Garcia et al., « Human rhinoviruses and enteroviruses in influenza-like illness in Latin America », Virol J., vol. 10, , p. 305 (PMID 24119298, PMCID 3854537, DOI 10.1186/1743-422x-10-305).
- « About Acute Flaccid Myelitis », CDC (consulté le ).
- (en) Pauline Anderson, « Les neurovirologues font un exposé sur une maladie neurologique mystérieuse », Medscape, .
- Oberste MS, Maher K, Schnurr D, et al. Enterovirus 68 is associated with respiratory illness and shares biological features with both the enteroviruses and the rhinoviruses. J Gen Virol 2004; 85: 2577–84
- Knoester, M., Helfferich, J., Poelman, R., Van Leer-Buter, C., Brouwer, O. F., Niesters, H. G., & 2016 EV-D68 AFM Working Group. (2018). Twenty-Nine Cases of Enterovirus-D68 Associated Acute Flaccid Myelitis in Europe 2016; A Case Series and Epidemiologic Overview. The Pediatric infectious disease journal.
- Pfeiffer, H. C., Bragstad, K., Skram, M. K., Dahl, H., Knudsen, P. K., Chawla, M. S., ... & Rojahn, A. E. (2015). Two cases of acute severe flaccid myelitis associated with enterovirus D68 infection in children, Norway, autumn 2014. Eurosurveillance, 20(10), 21062.
- Knoester, Marjolein et al. on behalf of the 2016 EV-D68 AFM Working Group, « Twenty-Nine Cases of Enterovirus-D68 Associated Acute Flaccid Myelitis in Europe 2016; A Case Series and Epidemiologic Overview », The Pediatric Infectious Disease Journal, .
- « About Acute Flaccid Myelitis », sur CDC (consulté le )
 Cet article reprend du texte de cette source, qui est dans le domaine public..
Cet article reprend du texte de cette source, qui est dans le domaine public.. - Hopkins, S., Gordon-Lipkin, E., Van Haren, K., Santoro, J., Munoz-Arcos, L., Matesanz, S., ... & Banwell B (2018) « MRI Brain Abnormalities in Acute Flaccid Myelitis: Characteristics and Differentiation from Acute Disseminated Encephalomyelitis » (P5. 145)
- Wang, C., Narayan, R., & Greenberg, B. (2018). Anti-Myelin Oligodendrocyte Glycoprotein Antibody Associated With Gray Matter Predominant Transverse Myelitis Mimicking Acute Flaccid Myelitis: A Presentation of Two Cases. Pediatric neurology.|résumé
- « Enterovirus D68 in the United States, 2014 » [archive du ], CDC, (consulté le ).
- « Doctors pioneer surgical treatment for rare, polio-like virus », CBS News, .
- Dan Hurley, « The mysterious polio-like disease affecting American kids », The Atlantic, .
- Michael Smith, « Children's Hospital: 10th Colorado child has paralysis-like symptoms; may be tied to Enterovirus 68 », ABC 7 News Denver.
- « CDC continues investigation of neurologic illness; will issue guidelines », AAP News/American Academy of Pediatrics, .
- Enterovirus D68 and Paralysis, « Enterovirus D68 and Paralysis », The Disease Daily/Outbreak News/Healthmap, .
- « Children's Hospital: 10th Colorado child has paralysis-like symptoms; may be tied to Enterovirus 68 », Thedenverchannel.com, .
- Saltzman E.B, Rancy S.K, Sneag D.B, Feinberg J.H, Lange D.J & Wolfe S.W (2018) Nerve Transfers for Enterovirus D68–Associated Acute Flaccid Myelitis: A case series. Pediatric neurology
- Hixon AM & al. (2018) « A mouse model of paralytic myelitis caused by enterovirus D68. » |PLoS Pathog. 2017 Feb 23;13(2):e1006199. doi: 10.1371/journal.ppat.1006199. eCollection 2017 Feb. | résumé
- Morrey, J. D., Wang, H., Hurst, B. L., Zukor, K., Siddharthan, V., Van Wettere, A. J., ... & Tarbet, E. B. (2018). Causation of Acute Flaccid Paralysis by Myelitis and Myositis in Enterovirus-D68 Infected Mice Deficient in Interferon αβ/γ Receptor Deficient Mice. Viruses, 10(1), 33.
- Wei, H. Y., Yeh, T. K., Hsieh, J. Y., Lin, I. P., & Yang, J. Y. (2018). « Updates on the molecular epidemiology of Enterovirus D68 after installation of screening test among acute flaccid paralysis patients in Taiwan ». Journal of Microbiology, Immunology and Infection.
- Greenberg B, Plumb P & Wang C (2018) Acute Flaccid Myelitis: Treatment Outcomes From a Tertiary Referral Center (P5. 095).| résumé