Oxydation par voie humide
L’oxydation par voie humide est un traitement des déchets aqueux contenant des composés organiques par oxydation, le plus souvent à l'aide d'oxygène et parfois d'un catalyseur, dans des conditions de haute température et haute pression pouvant atteindre l'état supercritique.
Histoire
L'oxydation par voie humide a été brevetée pour la première fois en Suède en 1911 pour la destruction des effluents de l'industrie du papier[1].
Toutefois, c'est son utilisation pour la production de vanilline synthétique en 1940 qui rend le procédé connu via le procédé Zimpro[2]. Ce procédé utilisait les effluents de l'industrie du papier comme matière première. Puis en modifiant les conditions opératoires, le procédé permit également l'élimination de la liqueur noire issue de la fabrication du papier avec une récupération d'énergie et de soude caustique.
Dans les années 1960, le procédé fut appliqué à des boues d'épuration pour améliorer leur traitement[3] - [4]. Cette application fut désignée sous le nom de LPO (Low Pressure Oxidation, oxydation à basse pression). Les deux décennies suivantes ont vu le développement de l'oxydation catalytique notamment pour le traitement de déchets industriels.
Les années 1990 ont conduit à l'extension de l'utilisation du procédé pour le traitement des boues d'épuration en Europe ainsi qu'à l'intégration du procédé dans la récupération de composés inorganiques dans les effluents industriels[5].
Parmi les principaux procédés industriels disponibles commercialement figurent
- le procédé Zimpro,
- le procédé ATHOS[6], le procédé LOPROX, le procédé Ciba-Geigy, le procédé WPO, le procédé Leroux&Lotz et le procédé ORCAN[7] - [8].
- le procédé INOVERTIS[9] - [10]
- le procédé WPO ou « Wet Peroxide Oxidation » (Oxydation en voie humide de la pollution organique aqueuse par le peroxyde d'hydrogène Procédé) [11],
- le procédé Clean WOx de la société suisse Granit Technologies SA.
Techniques et procédés
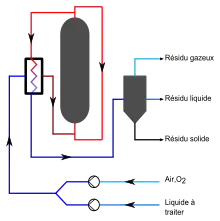
Le principe est le même que pour l'incinération : l'oxydation des composés, mais dans un milieu aqueux à haute température (200 à 300 °C) et haute pression (20-150 bar) en présence d'un composé oxydant (air, dioxygène, eau oxygénée, etc.) et parfois d'un catalyseur[8].
Un temps de réaction de quelques minutes à plusieurs heures peut être nécessaire pour réduire la concentration des produits organiques en fonction de leur dégradabilité. Entre 75 et 90 % de la matière organique mesurée en demande chimique en oxygène (DCO) est ainsi éliminée[8]. Les produits du traitement consistent en gaz carbonique, diazote et vapeur d'eau pour les effluents gazeux et solution aqueuse d'acide acétique, d'ammoniaque, de sulfates, de phosphates et de sels d'halogénures pour les effluents liquides. Un résidu solide est également présent constitué de sels minéraux insolubles.
Comme l'oxydation de composés organiques est exothermique, la réaction est auto-entretenue si la concentration en matière organique est suffisante et permet dans des conditions optimales de récupérer de l'énergie sous forme de vapeur.
Une amélioration du rendement peut être atteinte par l'utilisation de catalyseur notamment à base de cuivre, de fer ou de manganèse (réduction de la DCO pouvant être supérieure à 99 %). D'autres catalyseurs sont également possibles (cobalt, bismuth, platine[7]) mais ne sont pas utilisés à l'échelle industrielle.
Utilisation actuelle
Ce procédé est notamment utilisé pour traiter par oxydation certains effluents de l'industrie chimique, comme le traitement des résidus phosphorés avec récupération du phosphore sous forme de phosphates. L'agroalimentaire est également un utilisateur de ce procédé pour le traitement d'effluents issus de l'industrie de l'huile d'olive (qui « produit chaque année une énorme quantité d'eaux usées (margines en langage de spécialistes), de l'ordre de 30 millions de m3, qui sont très chargées en composés organiques (carbone organique total - COT jusqu'à 70 g. L-1), et qui sont phytotoxiques et non biodégradables »)[12]. Les déchets urbains avec notamment les boues d'épuration sont régulièrement traités par oxydation par voie humide [13]).
Des applications plus confidentielles telle la destruction des résines échangeuses d'ions radioactives issues de certains processus de filtration de l'Industrie nucléaire permettant la concentration et donc une manipulation plus aisée des éléments radioactifs[14].
Produits de dégradation
Comme souvent dans le domaine de la chimie organique, la dégradation des molécules complexes n'est pas complète, et des recombinaison peuvent se produire durant le processus entre les produits de dégradation, entre ces produits et l'oxydant et avec la molécule mère non encore décomposée. Ces sous-produits peuvent aussi être issus de l'action du ou des catalyseurs utilisés ou éventuellement présents dans le déchet ou le produit traité ; Ils peuvent à leur tour être chimiquement ou toxicologiquement actif, et devraient donc être pris en compte dans l'ensemble de l'analyse des filières déchets ou des ACV. Ils peuvent être issus de réactions complexes qu'on ne sais pas encore modéliser. Seule l'expérimentation et les analyses en conditions réelles permettent de les identifier avec certitude.
A tire d'exemple[15], lors d'une expérimentation visant à oxyder des phénols en voie humide dopée par des catalyseurs monométalliques (dans ce cas à base de platine ou de ruthénium supportés sur cérine ou sur cérine dopée), il se forme un dépôt carboné tout au long de la réaction, composé d'espèces organiques adsorbées sur toute la surface du catalyseur ; on y trouve « des composés polycycliques aromatiques de la famille des chroménones, des xanthénones et des fluorénones ont pu être extraits et identifiés par des techniques chromatographiques couplées à la spectrométrie de masse. Ces espèces sont issues de la condensation du phénol avec des produits de son oxydation incomplète »[15].
« Équivalent » naturel
Des processus hydrochimiques et hydrothermaux en partie similaires (mais en milieu anoxique) ont été géologiquement à l'œuvre dans certains charbons durant leur processus de houillification à grande profondeur (conditions haute pression/haute température)[16].
Notes et références
- (en) Vedprakash S. Mishra, « Wet Air Oxidation », Industrial & Engineering Chemistry Research, vol. 34, no 1, , p. 2-48 (DOI 10.1021/ie00040a001)
- F. J. Zimmermann, Brevet US 2399607, 1943
- E. W. Schoeffel, Brevet US 3060118, 1962
- G. H. Teletzke, Brevet US 3256179, 1966
- (en) C. Maugans et C. Ellis, « Wet Air Oxidation: A Review of Commercial Sub-Critical Hydrothermal Treatment », Twenty First Annual International Conference on Incineration and Thermal Treatment Technologies, (lire en ligne)
- « Présentation du procédé ATHOS » (consulté le )
- (en) Suresh K. Bhargava, « Wet Oxidation and Catalytic Wet Oxidation », Industrial & Engineering Chemistry Research, vol. 45, no 4, , p. 1221-1258 (DOI 10.1021/ie051059n)
- (en) F. Luck, « Wet air oxidation: past, present and future », Catalysis Today, vol. 53, no 1, , p. 81-91 (DOI 10.1016/S0920-5861(99)00112-1)
- Sébastien Lefèvre, « PROCEDE DE DIMENSIONNEMENT D’UNE COLONNE A BULLES DESTINEE A ETRE UTILISEE POUR LE TRAITEMENT D’EFFLUENTS AQUEUX PAR OXYDATION EN VOIE HUMIDE. », Brevet FR3050944 (A1),
- Olivier BOUTIN, « Procédés d'oxydation en voie humide », Techniques de l'ingénieur, (lire en ligne)
- Falcon, M., Peyrille, B., Reihac, P., Foussard, J. N., & Debellefontaine, H. (1993). Oxydation en voie humide de la pollution organique aqueuse par le peroxyde d'hydrogène Procédé « Wet Peroxide Oxidation » (WPO) Étude de nouveaux catalyseurs. Revue des sciences de l'eau/Journal of Water Science, 6(4), 411-426
- Doan Pham Minh, « Oxydation par voie humide catalytique des eaux usées de la production d'huile d'olives : catalyseurs métaux nobles supportés (Doctoral dissertation, Lyon 1) », (consulté le )
- Sève, E., & Antonini, G., Traitement des graisses de station d’épuration urbaine par oxydation en voie humide, vol. 76(3), (lire en ligne), p. 179-187
- Dubois, M. A. (1994). Dégradation des résines échangeuses d'ions par Oxydation par Voie Humide en conditions sous-critiques et supercritiques (Doctoral dissertation) (résumé Inist-CNRS)
- Keav, S., Martin, A., Barbier Jr, J., & Duprez, D. (2010). Nature du dépôt formé au cours de l’oxydation en voie humide catalysée du phénol. Comptes Rendus Chimie, 13(5), 508-514.résumé
- Srinivasaraghavan V. (2013), Influence of coal lithotype composition on the oxydative hydrothermal dissolution (OHD) process. In Geological Society of America Abstracts with Programs (Vol. 45, N°7) oct 2013.
Voir aussi
Bibliographie
- Levec, J. (1997). Wet oxidation processes for treating industrial wastewaters. Chemical and biochemical engineering quarterly, 11(1), 47-58 (http://cat.inist.fr/?aModele=afficheN&cpsidt=2612882 résumé]).