Nitrure de tantale
Les nitrures de tantale sont des céramiques constituées de tantale et d'azote. Ils existent selon plusieurs stœchiométries et plusieurs polymorphes : Ta2N, TaN α, TaN ε, Ta5N6, Ta4N5 et Ta3N5. Le plus utilisé d'entre eux est le mononitrure de tantale TaN, qui est une céramique ultraréfractaire. Il est employé comme barrière et couche adhésive (diélectrique low-k (en)) dans la production de circuits intégrés.
| Nitrure de tantale | |
| |
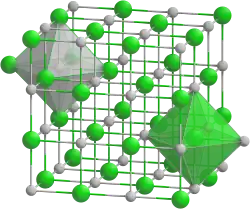
| __ Ta3+ __ N3− Structure cristalline du nitrure de tantale |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.031.613 |
| No CE | 234-788-4 |
| PubChem | 82832 |
| Propriétés chimiques | |
| Formule | TaN |
| Masse molaire[1] | 194,954 6 ± 0,000 2 g/mol N 7,18 %, Ta 92,82 %, |
| Propriétés physiques | |
| T° fusion | 2 950 °C[2] |
| Masse volumique | 14,3 g·cm-3[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est possible d'obtenir des couches de nitrure de tantale de plusieurs manières. La méthode la plus utilisée est la pulvérisation cathodique de tantale en présence d'ions d'azote (pulvérisation réactive). Les procédés par dépôt chimique en phase vapeur ou par Atomic Layer Deposition sont également envisageables. Ils nécessitent des précurseurs organométalliques comme sources de tantale. Une source d'azote est également nécessaire, comme l'ammoniac NH3, fréquemment utilisé, qui se dissocie aux températures habituelles de 200 à 400 °C de ces procédés. Des gaz tels que le tris(diéthylamido)(tert-butylimido)tantale(V) (CH3)3CNTa(N(C2H5)2)3 (n° CAS ) peuvent servir de source à la fois de tantale et d'azote. Outre ces techniques, il est également possible de procéder par implantation ionique d'azote dans des couches de tantale.
Le nitrure de tantale(V) Ta3N5 peut être obtenu en faisant réagir de l'oxyde de tantale(V) Ta2O5 avec de l'ammoniac NH3 ou du chlorure de tantale(V) TaCl5 avec du chlorure d'ammonium NH4Cl[3] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Tantalum nitride, 99.5% (metals basis) », sur Alfa Aesar (consulté le ).
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, 3e éd., vol. III, Ferdinand Enke, Stuttgart 1981, p. 1472. (ISBN 3-432-87823-0)