Neurexine
Les neurexines (NRXN) sont une famille de protéines d'adhésion cellulaire présynaptique qui jouent un rôle dans la connexion des neurones à la synapse[1]. Elles sont principalement situées sur la membrane présynaptique et contiennent un seul domaine transmembranaire. Le domaine extracellulaire interagit avec les protéines de la fente synaptique, notamment la neuroligine, tandis que la partie cytoplasmique intracellulaire interagit avec les protéines associées à l'exocytose[2]. La neurexine et la neuroligine se « serrent la main », entraînant la connexion entre deux neurones et la production d'une synapse[3]. Les neurexines assurent la médiation de la signalisation à travers la synapse ; elles influencent les propriétés des réseaux de neurones, par les spécificités de leurs synapses.
Les neurexines ont été découvertes en tant que récepteurs de l'α-latrotoxine, une toxine spécifique aux vertébrés dans le venin d'araignée veuve noire qui se lie aux récepteurs présynaptiques et induit une libération massive de neurotransmetteurs[4].
Chez l'homme, des altérations des gènes codant pour les neurexines sont impliquées dans l'autisme et d'autres maladies neuro-cognitives (ex. : syndrome de Tourette et schizophrénie)[4].
Structure
Chez les mammifères, la neurexine est codée par trois gènes différents (NRXN1, NRXN2 et NRXN3). Chacun est contrôlé par deux promoteurs différents, un alpha en amont (α) et un bêta en aval (β), résultant en alpha-neurexines 1-3 (α- neurexines 1-3) et bêta-neurexines 1-3 (β-neurexines 1-3)[5].
Il existe un épissage alternatif sur cinq sites dans l'α-neurexine et deux dans la β-neurexine ; plus de 2 000 variantes d'épissage sont possibles au total, suggèrent que les neurexines ont un rôle important dans la détermination de la spécificité des synapses[6].
Les protéines codées sont structurellement similaires à la laminine, à la slit et à l'agrine, trois autres protéines impliquées dans le guidage axonal et la synaptogenèse[6].
Les α-neurexines et les β-neurexines ont des domaines intracellulaires identiques mais des domaines extracellulaires différents. Le domaine extracellulaire de l'α-neurexine est composé de trois répétitions de neurexine qui contiennent chacune des domaines LNS (laminine, neurexine, globuline liant les hormones sexuelles) - EGF (facteur de croissance épidermique) - LNS. N1α se lie à une variété de ligands, y compris les neuroligines et les récepteurs GABA[2], bien que les neurones de chaque type de récepteur expriment des neurexines.
Les β-neurexines sont des versions plus courtes des α-neurexines, contenant un seul domaine LNS[7]. Les β-neurexines (situées en position présynaptique) agissent comme des récepteurs pour la neuroligine (situées en position post-synaptique). De plus, la β-Neurexine s'est également avérée jouer un rôle dans l'angiogenèse[8].
L'extrémité C-terminale de la courte section intracellulaire des deux types de neurexines se lie à la synaptotagmine et aux domaines PDZ (densité post-synaptique (PSD)-95/discs large/zona-occludens-1) de CASK et Mint. Ces interactions forment des connexions entre les vésicules synaptiques intracellulaires et les protéines de fusion[9]. Ainsi, les neurexines jouent un rôle important dans l'assemblage de la machinerie présynaptique et post-synaptique.
Trans-synapses, les domaines LNS extracellulaires possèdent une région fonctionnelle, la surface hyper-variable, formée de boucles portant trois inserts d'épissage[2]. Cette région entoure un ion Ca <sup id="mwUQ">2+</sup> coordonné et est le site de liaison de la neuroligine[9] résultant en un complexe neurexine-neuroligine Ca 2+ dépendant à la jonction des synapses chimiques[10].
Expression et fonction
Les neurexines sont distribuées de manière diffuse dans les neurones, mais se concentrent aux terminaisons présynaptiques à mesure que les neurones mûrissent. Il existe un dialogue trans-synaptique entre la neurexine et la neuroligine[11]. Ce déclencheur bidirectionnel aide à la formation de synapses, c'est un élément clé pour modifier le réseau neuronal. La surexpression de l'une ou l'autre de ces protéines provoque une augmentation des sites de formation de synapses, fournissant ainsi la preuve que la neurexine joue un rôle fonctionnel dans la synaptogenèse[7]. À l'inverse, le blocage des interactions β-neurexine réduit le nombre de synapses excitatrices et inhibitrices.
On ne sait pas encore comment la neurexine favorise la formation de synapses. Une possibilité est que l'actine serait polymérisée à l'extrémité arrière de la β-neurexine, qui piège et stabilise les vésicules synaptiques qui s'accumulent. Cela forme un cycle d'alimentation vers l'avant, où de petits groupes de β-neurexines recrutent plus de β-neurexines et de protéines d'échafaudage pour former un grand contact adhésif synaptique[7].
Liaison neurexine-neuroligine
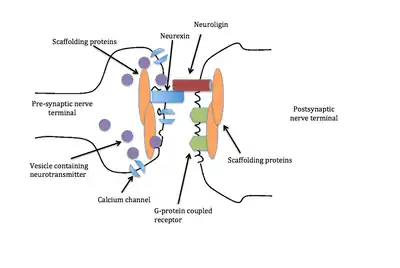
Les différentes combinaisons entre neurexine à neuroligine ainsi que l'épissage alternatif des gènes de neuroligine et de neurexine contrôlent la liaison entre les neuroligines et les neurexines, ajoutant à la spécificité des synapses[12].
Les neurexines seules peuvent recruter des neuroligines dans les cellules postsynaptiques vers une surface dendritique, ce qui entraîne des récepteurs de neurotransmetteurs regroupés et d'autres protéines et machines postsynaptiques. Leurs partenaires neuroligines peuvent induire des terminaisons présynaptiques en recrutant des neurexines. La formation de synapses peut donc être déclenchée dans les deux sens par ces protéines[9].
Les neuroligines et les neurexines régulent aussi la formation de synapses glutamatergiques (excitatrices) et les contacts GABAergiques (inhibitrices) en utilisant un lien neuroligine. La régulation de ces contacts suggère que la liaison neurexine-neuroligine pourrait équilibrer l'entrée synaptique[6] ou maintenir un rapport optimal entre les contacts excitateurs et inhibiteurs.
Implication dans d'autre interactions
Les neurexines ne se lient pas seulement à la neuroligine. Les partenaires de liaison supplémentaires de la neurexine sont le dystroglycane et les neuroexophilines[9]. Le dystroglycane dépend du Ca 2+ et se lie préférentiellement aux α-neurexines sur les domaines LNS dépourvus d'inserts d'épissage. Chez la souris, une délétion du dystroglycane provoque une altération de la potentialisation à long terme et des anomalies du développement similaires à la dystrophie musculaire ; cependant, la transmission synaptique de base est normale. Les neuroexophilines sont indépendantes du Ca 2+ et se lient exclusivement aux α-neurexines sur le second domaine LNS. L'augmentation des réponses de sursaut et la coordination motrice altérée des souris knock-out pour la neuroexophiline indiquent que les neuroexophilines ont un rôle fonctionnel dans certains circuits[9]. La signification de la relation entre la neurexine et le dystroglycane ou les neuroexophilines n'est toujours pas claire.
Répartition au sein des espèces
Les membres de la famille des neurexines n'existent pas chez tous les animaux (en particulier chez les métazoaires basaux tels que les porifères (éponges), les cnidaires (méduses) et les Ctenophora (organismes planctoniques marins carnivores, transparents et à symétrie rotationnelle). Les porifères n'ayant pas de synapses, le rôle des neurexines dans ces organismes reste inconnu.
Des homologues de l'α-neurexine ont été retrouvés chez plusieurs espèces d'invertébrés, notamment la drosophile, Caenorhabditis elegans, les abeilles et l'aplysie[11].
Chez Drosophila melanogaster, les gènes NRXN (une seule α-neurexine) sont critiques dans l'assemblage des jonctions neuromusculaires glutamatergiques mais sont beaucoup plus simples[5]. Leurs rôles fonctionnels chez les insectes sont probablement similaires à ceux des vertébrés[13].
Rôle dans la maturation synaptique
La neurexine et la neuroligine sont actives dans la maturation des synapses et pour l'adaptation de la force synaptique.
Des études chez des souris knock-out montrent que les groupes de liens trans-synaptiques n'augmentent pas le nombre de sites synaptiques, mais plutôt la force des synapses existantes[11]. La suppression des gènes de la neurexine chez les souris a considérablement altéré la fonction synaptique, mais sans modifier la structure synaptique. Ceci est attribué à l'altération de canaux ioniques spécifiques (voltage-dépendants). La neuroligine et la neurexine ne sont pas indispensables à la formation synaptique, mais elles sont des composants essentiels pour son bon fonctionnement[11].
Importance clinique et applications
Des mutations dans les gènes codant pour la neurexine et la neuroligine ont été récemment reliées à un éventail de troubles cognitifs : troubles du spectre autistique (TSA), schizophrénie et déficience mentale[4]. Les mécanismes de ces états ou maladies cognitives restent difficiles à comprendre, car se caractérisant par des changements subtils dans un sous-groupe de synapses dans un circuit plutôt que par une altération de tous les systèmes dans tous les circuits.
Selon le circuit touché, ces modifications subtiles des synapses semblent produire des symptômes neurologiques particuliers, correspondant a priori à la classification de différentes maladies. Des contre-arguments à ce lien suspecté entre troubles cognitifs et mutations existent. Ils invitent à approfondir la connaissance des mécanismes sous-jacents à ces troubles cognitifs.
Autisme, TSA
L'autisme est un trouble neurodéveloppemental caractérisé par des déficits qualitatifs du comportement social et de la communication, comprenant souvent des schémas de comportement spécifiques, envahissants et répétitifs[14]. Il comprend un sous-ensemble de trois troubles :
- syndrome d'Asperger (SA),
Un faible pourcentage de patients atteints de TSA présentent des mutations uniques dans les gènes codant pour les molécules d'adhésion cellulaire neuroligine-neurexine. La neurexine est cruciale pour la fonction synaptique et la connectivité, comme le souligne le large éventail de phénotypes neurodéveloppementaux chez les personnes présentant des délétions de la neurexine. Ceci prouve que les délétions de la neurexine entraînent un risque accru de TSA et indiquent un dysfonctionnement des synapses comme site possible d'origine de l'autisme[15].
Les expériences sur les souris KO de l'α-neurexine II (Nrxn2α) du Dr Steven Clapcote et al. démontrent un rôle causal de la perte de Nrxn2α dans la genèse des comportements liés à l'autisme chez la souris[16].
Schizophrénie
La schizophrénie est une maladie neuropsychiatrique très handicapante avec de multiples gènes et expositions environnementales impliquées dans sa genèse[17]. La suppression du gène NRXN1 augmente le risque de schizophrénie[18].
Les duplications et les délétions génomiques au niveau micro — appelées variantes du nombre de copies (CNV) — sous-tendent souvent les syndromes neurodéveloppementaux. Les analyses à l'échelle du génome suggèrent que les personnes atteintes de schizophrénie ont des variantes structurelles rares qui ont supprimé ou dupliqué un ou plusieurs gènes[17].
Vers 2005, ces études n'indiquent qu'un risque accru. Des recherches supplémentaires sont nécessaires pour élucider les mécanismes sous-jacents de la genèse des maladies cognitives[19].
Déficience intellectuelle et syndrome de Gilles de la Tourette
Comme la schizophrénie, la déficience intellectuelle et le syndrome de Tourette sont associés aux délétions de NRXN1[4] - [17]. Les gènes NRXN 1 à 3 sont essentiels à la survie et jouent un rôle central et qui se chevauchent les uns avec les autres dans le développement neurologique. Ces gènes sont directement perturbés dans le syndrome de Tourette par des réarrangements génomiques indépendants[20]. Les mutations NLGN4 peuvent être associées à un large éventail de troubles neuropsychiatriques qui semblent plus légers[21].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Neurexin » (voir la liste des auteurs).
- (en) Xiang Li, Jiahai Zhang, Zanxia Cao, Jihui Wu et Yunyu Shi, « Solution structure of GOPC PDZ domain and its interaction with the C-terminal motif of neuroligin », Protein Science, vol. 15, no 9, , p. 2149–58 (ISSN 0961-8368, e-ISSN 1469-896X, PMID 16882988, PMCID 2242614, DOI 10.1110/ps.062087506).
- (en) Fang Chen, Vandavasi Venugopal, Beverly Murray et Gabby Rudenko, « The structure of neurexin 1α reveals features promoting a role as synaptic organizer », Structure, vol. 19, no 6, , p. 779–89 (PMID 21620716, PMCID 3134934, DOI 10.1016/j.str.2011.03.012).
- (en) « Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons », Cell, vol. 101, no 6, , p. 657–69 (PMID 10892652, DOI 10.1016/S0092-8674(00)80877-6, S2CID 16095623).
- (en) Südhof TC, « Neuroligins and neurexins link synaptic function to cognitive disease », Nature, vol. 455, no 7215, , p. 903–11 (PMID 18923512, PMCID 2673233, DOI 10.1038/nature07456, Bibcode 2008Natur.455..903S).
- (en) « SnapShot: Neuroligin-neurexin complexes », Cell, vol. 141, no 5, , p. 908–908.e1 (PMID 20510934, DOI 10.1016/j.cell.2010.05.024).
- (en) Binder MD, Encyclopedia of Neuroscience: Neurexins, Springer Berlin Heidelberg, , 2607 p. (ISBN 978-3-540-29678-2).
- (en) « Neuroligins and neurexins: linking cell adhesion, synapse formation and cognitive function », Trends Neurosci., vol. 29, no 1, , p. 21–9 (PMID 16337696, DOI 10.1016/j.tins.2005.11.003, S2CID 11664697).
- (en) « The synaptic proteins neurexins and neuroligins are widely expressed in the vascular system and contribute to its functions », Proc. Natl. Acad. Sci. U.S.A., vol. 106, no 49, , p. 20782–20787 (PMID 19926856, PMCID 2791601, DOI 10.1073/pnas.0809510106, Bibcode 2009PNAS..10620782B).
- (en) Ann Marie Craig et Yunhee Kang, « Neurexin–neuroligin signaling in synapse development », Current Opinion in Neurobiology, vol. 17, no 1, , p. 43–52 (PMID 17275284, PMCID PMC2820508, DOI 10.1016/j.conb.2007.01.011, lire en ligne, consulté le ).
- (en) « Mutational analysis of the neurexin/neuroligin complex reveals essential and regulatory components », Proc. Natl. Acad. Sci. U.S.A., vol. 105, no 39, , p. 15124–15129 (PMID 18812509, PMCID 2551626, DOI 10.1073/pnas.0801639105, Bibcode 2008PNAS..10515124R).
- (en) David Knight, Wei Xie et Gabrielle L. Boulianne, « Neurexins and neuroligins: recent insights from invertebrates », Molecular Neurobiology, vol. 44, no 3, , p. 426–440 (ISSN 0893-7648 et 1559-1182, PMID 22037798, PMCID 3229692, DOI 10.1007/s12035-011-8213-1).
- (en) Camin Dean et Thomas Dresbach, « Neuroligins and neurexins: linking cell adhesion, synapse formation and cognitive function », Trends in Neurosciences, vol. 29, no 1, , p. 21–29 (DOI 10.1016/j.tins.2005.11.003, lire en ligne, consulté le ).
- (en) « Bridging the synaptic gap: neuroligins and neurexin I in Apis mellifera », PLOS ONE, vol. 3, no 10, , e3542 (PMID 18974885, PMCID 2570956, DOI 10.1371/journal.pone.0003542, Bibcode 2008PLoSO...3.3542B).
- (en) « Autism spectrum disorders », Neuron, vol. 28, no 2, , p. 355–63 (PMID 11144346, DOI 10.1016/S0896-6273(00)00115-X, S2CID 7100507).
- (en) « Alterations of GABAergic signaling in autism spectrum disorders », Neural Plast., vol. 2011, , p. 297153 (PMID 21766041, PMCID 3134996, DOI 10.1155/2011/297153).
- (en) J. Dachtler et J. Glaspe, « Deletion of α-neurexin II results in autism-related behaviors in mice », Translational Psychiatry, vol. 4, no 11, , e484 (PMID 25423136, PMCID 4259993, DOI 10.1038/tp.2014.123).
- (en) « Rare structural variants disrupt multiple genes in neurodevelopmental pathways in schizophrenia », Science, vol. 320, no 5875, , p. 539–543 (PMID 18369103, DOI 10.1126/science.1155174, Bibcode 2008Sci...320..539W, S2CID 14385126).
- (en) « Neurexin 1 (NRXN1) deletions in schizophrenia », Schizophr Bull, vol. 35, no 5, , p. 851–854 (PMID 19675094, PMCID 2728827, DOI 10.1093/schbul/sbp079).
- (en) « Comparative genome hybridization suggests a role for NRXN1 and APBA2 in schizophrenia », Hum. Mol. Genet., vol. 17, no 3, , p. 458–465 (PMID 17989066, DOI 10.1093/hmg/ddm323).
- (en) « Transplantation of islets of Langerhans in diabetic rats », Acta Physiol Lat Am, vol. 27, no 1, , p. 1–6 (PMID 356520).
- (de) Kuttig P, « [Social service for paraplegics and childhood paralytics] », Dtsch Schwesternztg, vol. 23, no 9, , p. 450–452 (PMID 5202006).
Voir aussi
Bibliographie
- (en) Magali H. Arons, Charlotte J. Thynne, Andreas M. Grabrucker et Dong Li, « Autism-Associated Mutations in ProSAP2/Shank3 Impair Synaptic Transmission and Neurexin–Neuroligin-Mediated Transsynaptic Signaling », Journal of Neuroscience, vol. 32, no 43, , p. 14966–14978 (ISSN 0270-6474 et 1529-2401, PMID 23100419, DOI 10.1523/JNEUROSCI.2215-12.2012, lire en ligne, consulté le ).
- (en) Rafael J. Camacho-Garcia, Mª. Inmaculada Planelles, Mar Margalef et Maria L. Pecero, « Mutations affecting synaptic levels of neurexin-1β in autism and mental retardation », Neurobiology of Disease, vol. 47, no 1, , p. 135–143 (ISSN 0969-9961, DOI 10.1016/j.nbd.2012.03.031, lire en ligne, consulté le ).
- (en) Luis G. Rabaneda, Estefanía Robles-Lanuza, José Luis Nieto-González et Francisco G. Scholl, « Neurexin Dysfunction in Adult Neurons Results in Autistic-like Behavior in Mice », Cell Reports, vol. 8, no 2, , p. 338–346 (ISSN 2211-1247, DOI 10.1016/j.celrep.2014.06.022, lire en ligne, consulté le ).
- (en) Alisha Tromp, Bryan Mowry et Jean Giacomotto, « Neurexins in autism and schizophrenia—a review of patient mutations, mouse models and potential future directions », Molecular Psychiatry, vol. 26, no 3, , p. 747–760 (ISSN 1476-5578, DOI 10.1038/s41380-020-00944-8, lire en ligne, consulté le ).
- (en) Jia Wang, Jianhua Gong, Li Li et Yanlin Chen, « Neurexin gene family variants as risk factors for autism spectrum disorder: Genetic risk for autism spectrum disorder », Autism Research, vol. 11, no 1, , p. 37–43 (DOI 10.1002/aur.1881, lire en ligne, consulté le ).