Monofluorophosphate
Le monofluorophosphate est un anion de formule chimique PO3F2−. Il est analogue à un groupe phosphate dont un atome d'oxygène est remplacé par un atome de fluor. Sa charge électrique est -2. Le monofluorophosphate ressemble à un ion sulfate SO42− par sa forme, sa taille, sa masse et sa charge, de sorte qu'il est susceptible de former des composés de structure semblable à celle des sulfates. Le plus connu d'entre eux est le monofluorophosphate de sodium Na2PO3F, qui entre couramment dans la composition des dentifrices, et dont la découverte en 1929 en Allemagne ouvrit la voie à la mise au point du sarin et des agents innervants apparentés.
| Monofluorophosphate | |
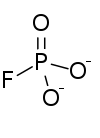
| |
| Structure de l'anion monofluorophosphate | |
| Identification | |
|---|---|
| Nom UICPA | fluoridophosphate |
| Synonymes |
Phosphorofluoridate |
| No CAS | |
| PubChem | 65241 |
| ChEBI | 42699 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | PO3F2− |
| Masse molaire[1] | 97,970 4 ± 0,000 9 g/mol F 19,39 %, O 48,99 %, P 31,62 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Les monofluorophosphates organiques peuvent être très toxiques. Le diisopropylfluorophosphate (H3C)2HC–O–P(=O)F–O–CH(CH3)2 par exemple est un inhibiteur de protéases à sérine :
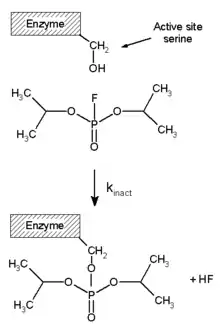
Les acétylcholinestérases sont également empoisonnées par ces composés[2].
Les verres à fluorophosphates ont une température de fusion peu élevée et sont un mélange de composés métalliques de fluorures et de phosphates. Par exemple, le verre de composition 10 % SnO, 40 % SnF2 et 50 % P2O5 fond aux environs de 139 °C. Le PbO et le PbF2 peuvent réduire la température de fusion et accroître la résistance à l'eau[3]. Ces verres peuvent également être colorés par divers autres éléments ainsi que par des pigments organiques.
Les monofluorophosphates peuvent être obtenus par hydrolyse basique de difluorophosphates :
Ils sont produits industriellement par réaction d'un fluorure F− avec un métaphosphate (en) PO3− :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) John W. Baynes et Marek H. Dominiczak, Medical Biochemistry E-Book, Elsevier Health Sciences, 2018, p. 72. (ISBN 9780702073007)
- (en) Cathy M. Shaw et James E. Shelby, « Effect of Lead Compounds on the Properties of Stannous Fluorophosphate Glasses », Journal of the American Ceramic Society, vol. 71, no 5, , C252-C253 (DOI 10.1111/j.1151-2916.1988.tb05071.x, lire en ligne)