Monochlorophénol
Le monochlorophénol, ou simplement chlorophénol, est un composé aromatique de formule C6H5ClO. Il est constitué d'un cycle benzénique substitué par un groupe hydroxyle (phénol) et un atome de chlore. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Propriétés
| Aminobenzaldéhyde | |||
| Nom | 2-Chlorophénol | 3-Chlorophénol | 4-Chlorophénol |
| Autre nom | orthochlorophénol o-chlorophénol |
métachlorophénol m-chlorophénol |
parachlorophénol p-chlorophénol |
| Formule structurelle | 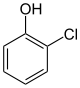 |
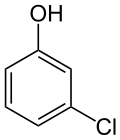 |
 |
| Numéro CAS | |||
| (mélange d'isomères) | |||
| Numéro ECHA | 100.002.213 | 100.003.257 | 100.003.094 |
| PubChem | 7245 | 7933 | 4684 |
| Formule brute | C6H5ClO | ||
| Masse molaire | 128,56 g·mol−1 | ||
| État | liquide | solide | |
| Apparence | liquide incolore odeur caractéristique[1] |
aiguilles incolores à grises odeur de type phénol[2] |
aiguilles incolores à grises odeur de type phénol[3] |
| Point de fusion | 7 °C[1] | 33 à 35 °C[2] | 43 °C[3] |
| Point d'ébullition | 174 °C[1] | 214 °C[2] | 220 °C[3] |
| Masse volumique (20 °C) | 1,23 g·cm-3[1] | 1,25 g·cm-3[2] | 1,31 g·cm-3[3] |
| Pression de vapeur | 2,3 hPa (20 °C)[1] | 1 hPa (40 °C)[2] | 13-15 hPa (20 °C)[3] |
| Point d'éclair (coupelle fermée) |
85 °C[1] | 120 °C[2] | 121 °C[3] |
| Point d'auto-inflammation | 550 °C[1] | 415 °C[2] | |
| Solubilité (eau, 20 °C) | 28,5 g·l-1[1] | 27,7 g·l-1[2] | 27 g·l-1[3] |
| pKA[4] | 8,48 | 9,08 | 9,38 |
| LogP | 2,15[1] | 2,5[2] | 2,39[3] |
| SGH[1] - [2] - [3] |    Danger |
  Attention |
   Danger |
| Phrase H et P[1] - [2] - [3] | H314, H411 et H302+H312+H332 |
H411 et H302+H312+H332 |
H290, H302, H312, H314, H332 et H411 |
| P273, P302+P352 et P305+P351+P338 |
P273 et P302+P352 |
– | |
Les chlorophénols sont des composés peu solubles dans l'eau, peu volatils, toxiques et partiellement cancérigènes. Comme ils sont chimiquement très stables, ils s'accumulent dans la chaîne alimentaire. Lorsque les chlorophénols sont chauffés, des dibenzodioxines polychlorées peuvent être formées avec élimination de chlorure d'hydrogène.
Le 4-chlorophénol, qui présente la plus grande symétrie, a le point de fusion le plus élevé ; le 2-chlorophénol est lui le sel isomère liquide à température ambiante. Les chlorophénols présentent une acidité plus élevée que le phénol (pKA de 9,99[4]) en raison de l'effet -I du substituant chlore.
Utilisation
Les chlorophénols sont fréquemment utilisés comme produits de préservation du bois, herbicides et fongicides, pour le blanchiment de la pâte à papier dans la production de papier, et comme intermédiaires dans la synthèse des produits pharmaceutiques et des colorants.
Le 2-chlorophénol est utilisé dans la fabrication de produits pharmaceutiques et de colorants, ainsi que comme désinfectant. Il est également présent comme polluant dans les eaux souterraines. Le 3-chlorophénol et le 4-chlorophénol sont utilisés comme intermédiaires dans la fabrication de produits pharmaceutiques et de colorants et comme désinfectants.
Notes et références
- Entrée « 2-Chlorophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire)
- Entrée « 3-Chlorophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire)
- Entrée « 4-Chlorophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6).