Miro rubisole
Petroica australis

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Aves |
| Ordre | Passeriformes |
| Sous-ordre | Passeri |
| Famille | Petroicidae |
| Genre | Petroica |
Répartition géographique
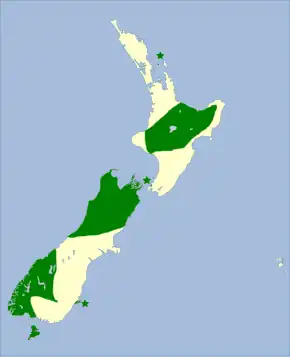
Le Miro rubisole (Petroica australis) est une espèce de passereaux[1] endémique de la Nouvelle-Zélande. Ce petit oiseau passériforme appartient à la famille des Petroicidae.
Nom
Le Miro rubisole est appelé New Zealand Robin en anglais (nom qui désigne également l'espèce Miro de Garnot), et toutouwai, en maori. R. P. Lesson et Garnot le qualifient de « rubisole » à cause de la couleur rouge du dessous des pattes[2].
Habitat
Le Miro rubisole est une espèce endémique de Nouvelle-Zélande. Il est, à la fois, natif de cette région et confiné à celle-ci. On le trouve sur l'île du Sud et l'île Stewart (maori de Nouvelle-Zélande : Rakiura). Sur certaines îles, comme l'île d'Ulva, il a été réintroduit, après son éradication par des prédateurs introduits (chats et rats, par exemple)[3].
Historiquement, l'espèce habite la majorité des basses terres de Nouvelle-Zélande. Lorsque les colons européens s'installent en Nouvelle-Zélande, l'espèce est présente sur la quasi-totalité du territoire. La distribution est maintenant dispersée, à cause de la perte d'habitat[4]. Dans certaines zones, l'oiseau est fréquent, dans d'autres, il est rare, et dans certaines, il a disparu. Il se rencontre dans les lisières de forêts et, souvent, dans les ceintures vertes des villages. La superficie de l'aire de répartition est estimée entre 50 000 et 100 000 km2[5].
Petroica australis australis a résisté légèrement mieux que Petroica australis rakiura à la perte d'habitat. On en trouve deux populations sur la côte est de l'île du Sud[6]. L'oiseau est relativement commun dans le nord et l'ouest de celle-ci[7] - [8]. Petroica australis rakiura est relégué dans trois sous-populations, habitant toutes des brousses marécageuses à Leptospermum. Bien que celles-ci ne constituent pas leur habitat favori, elles sont beaucoup moins peuplées de mammifères prédateurs. Durant un temps, la population totale de l'île Stewart se réduit à moins de 500 individus[8] - [9]. Depuis, certains individus ont été transférés sur des îles dépourvues de prédateurs (rats, hermines, trichosurus), comme les îles d'Ulva, Motuara et Nukuwaiata. Ces introductions ont été relativement réussies (environ 600 individus sur la seule île de Motuara)[10].
Sur l'île du Sud, Petroica australis a une forte attirance pour les plantations de pin Douglas, par comparaison avec les forêts indigènes (Kunzea ericoides) ou les plantations de pins de Monterey. Il semble que ce soit essentiellement dû à la structure des forêts, plus qu'à la disponibilité de la nourriture ou de sites viables de nidification. Le Miro rubisole préfère les forêts à structure simple, avec des canopées denses et régulières, et au sol couvert de débris de feuilles[4]. On le trouve principalement dans les forêts adultes de hêtres et de Podocarpus et aussi dans les fourrés de kanuka et manuka[11].
Lors de l'introduction de nouvelles populations sur l'île d'Ulva, on a observé une nidification et une présence accrues dans les végétations côtières à larges feuilles. Bien que la structure de la végétation soit le premier déterminant du choix de leur lieu de résidence, les miros rubisole ont une importante flexibilité dans la détermination des emplacements de nidification[6].
Conservation
Dans la liste rouge des espèces protégées, le Miro rubisole (Petroica australis) est considéré comme non menacé. En Nouvelle-Zélande, c'est une espèce endémique protégée, comme la plus grande partie des oiseaux endémiques de Nouvelle-Zélande[8]. Les populations sont menacées par les pertes d'habitats, dues aux activités humaines, et à la prédation par des espèces introduites. Les actions de protection visent à la conservation des populations existantes et à la réintroduction de l'espèce là où elle a été éradiquée.
La sous-espèce Petroica australis rakiura est vulnérable. Elle a été l'objet de diminution de populations, en raison de la déforestation et la perte d'habitat, ainsi que de l'introduction de prédateurs, tels que les rats, les hermines et les chats sauvages[6] - [8] - [12]. En raison de cette forte baisse de la population sur l'île Stewart, plusieurs tentatives ont été faites pour transporter Petroica australis rakiura dans d'autres îles proches, où les prédateurs introduits n'existent pas ou ont été éradiqués. Parmi celles-ci, il y a les îles d'Ulva, Motuara et Nukuwaiata. Sur l'île d'Ulva, la translocation a eu lieu en 2000. 21 individus, appelés « fondateurs », sont restés sur l'île. Entre 2000 et 2001, on n'enregistre que deux naissances. La population atteint environ 500 oiseaux en 2010 et il reste encore, à cette date, cinq fondateurs. Tous ces oiseaux sont bagués[13].
Bon nombre de translocations ont concerné 12 individus colonisateurs ou moins, impliquant que la consanguinité est presque inévitable. Cela a conduit à certains problèmes d'immunocompétence apparente, ainsi que de reproduction. Sur l'île de Motuara, on a observé un taux d'échec élevé lors de la nidification, ainsi qu'un nombre réduit de couvées. En outre, même si les charges parasitaires sont identiques entre ces populations réduites et leurs populations sources, la réponse immunitaire, au niveau cellulaire, n'est pas aussi forte dans la population réduite[10]. Par conséquent, c'est un sujet de préoccupation important que, bien que certaines de ces populations sont effectivement croissantes, il pourrait y avoir trop de consanguinité et le système immunitaire et la reproduction serait compromis. D'autre part, bien que la distribution de Petroica australis australis sur l'île est de plus en plus fragmentée, celui-ci ne montre pas beaucoup de perte de diversité génétique, en comparaison avec les populations historiques[14]. Ainsi, il pourrait s'en sortir un peu mieux que son homologue de l'île Stewart.
Empoisonnement au fluoroéthanoate de sodium
On a enregistré un certain nombre de décès de miros rubisoles, par empoisonnement accidentel au fluoroéthanoate de sodium (1080), à la suite de traitements antiparasitaires[15]. La plupart de ceux-ci est associée à quatre opérations des années 1980, qui ont utilisé, comme appâts, des carottes de mauvaise qualité[16]. Ces cas mis à part, les miros rubisoles ont généralement bien répondu aux programmes de lutte contre les ravageurs utilisant des pulvérisations aériennes de 1080. Les couvées ont augmenté, ainsi que le taux de survie des adultes, et la taille des populations a augmenté[17]. L'étude scientifique, réalisée en 2012 par l'université d'Otago, d'une population marquée, montre que les opérations actuelles d'empoisonnement par le 1080, à l'aide d'appâts de céréales, n'ont aucun impact négatif sur les miros rubisoles et sont susceptibles d'augmenter les populations, en éliminant la menace de mammifères prédateurs[18] - [19].
Description

Le miro rubisole, alors appelé « gobe-mouche rubisole » (muscicapa toï-toï), est observé dans la Baie-des-Ile, à Aoraki, lors du voyage, en Nouvelle-Zélande, de la Coquille. Il est décrit par Garnot :
« Gobe-mouches, le front, l'abdomen, la partie centrale des ailes, les rémiges et rectrices blancs, d'autres parties du corps, le bec et les pattes noirs, sous les pattes de la couleur de cinabre[2] - [20]. »
Le miro rubisole est petit, de la taille d'un moineau. Son corps atteint une longueur de 10 à 18 centimètres[21], pour une masse de l'ordre de 35 g[11]. L'oiseau se tient sur des pattes verticales, longues et minces[11] - [8] - [22]. Le plumage du mâle est gris ardoise à gris foncé, celui de la femelle, gris-brun. Les deux sexes ont la gorge et le ventre beaucoup plus clair, allant jusqu'au crème chez le mâle. Cette tache est à l'origine du nom anglais Robin, par rapprochement avec la gorge brillante des rouge-gorges européens. Les yeux, le bec et les pattes sont noirs, le dessous des pattes rouge.
Les deux sous-espèces et le Miro de Garnot sont très similaires. Ce dernier, ainsi que Petroica australis rakiura, ressemble aux femelles et aux juvéniles de Petroica australis australis, ce qui rend l'identification parfois délicate. Cependant, la provenance géographique est un critère déterminant. Dans chaque sous-espèce, les femelles et les juvéniles sont très similaires. Seuls les juvéniles tout juste indépendants peuvent ne pas encore avoir la gorge plus claire des mâles[23].
Les mâles de Petroica australis australis sont de couleur gris foncé, avec la partie inférieure de la gorge de couleur blanc jaunâtre. Les femelles et les juvéniles sont d'un gris plus clair, avec une gorge moins distincte[8]. Les mâles de Petroica australis rakiura sont presque noirs, avec une tache blanche au-dessus du bec, et la gorge inférieure blanc grisâtre. Les femelles et les juvéniles tirent plus sur le gris, avec des taches pâles plus variables, sur la gorge et la poitrine[8] - [24].
Systématique
Le Petroica australis australis (Sparrman, 1788, anglais : South Island Robin) et le Petroica australis rakiura (Fleming, CA, 1950, anglais : Stewart Island Robin) sont maintenant reconnus comme des sous-espèces[1] - [8] - [25]. Le Miro de Garnot (anciennement Petroica australis longipes, Lesson & Garnot, 1827), étroitement apparenté et vivant dans l'île du Nord, est classé, en fonction des études réalisées, par Miller et Lambert, en 2006, comme une espèce distincte, à cause de la profonde divergence phylogénétique des séquences des acides désoxyribonucléiques mitochondriaux[7]. Cela n'est pas encore accepté par les principaux organismes de protection de la nature et de recherche biologique[21] - [26] - [27], bien que ce soit le cas du département de la protection de Nouvelle-Zélande[12].
 Petroica australis australis.
Petroica australis australis. Petroica australis rakiura.
Petroica australis rakiura.
Deux autres espèces génétiquement proches sont le très rare Miro des Chatham (Petroica Traversi, anglais : Black Robin), sur les îles Chatham et le Miro mésange (Petroica macrocephala). Le premier semble être un descendant de Petroica australis dans les îles Chatham. La position de l'ancêtre commun le plus proche de Petroica australis et Petroica macrocephala n'a pas encore été déterminée[7].
Les croisements entre les deux sous-espèces sont possibles, mais ne se produisent pas, à cause de leur séparation géographique. C'est la raison pour laquelle il s'agit de deux sous-espèces. La famille des Petroicidae, à laquelle appartient le Miro rubisole, comporte 44 espèces d'Australie, de Nouvelle-Zélande et de Nouvelle-Guinée, appelées, en anglais, Australo-Papuan robins. Elle n'est pas voisine des North American robin (famille des Turdidae), ni de celle des Eurasian robins (famille des Muscicapidae).
Comportement
Le miro rubisole est très confiant et naturellement curieux des humains. Il suit fréquemment les promeneurs, dans l'espoir que ceux-ci dérangent les feuilles tombées au sol, lui permettant de capturer des insectes ainsi mis au jour[13]. Comme il est docile, il peut être facilement apprivoisé[28]. Ainsi, sur l'île d'Ulva, Ian Jamieson, chercheur à l’université d’Otago, a dressé les miros rubisoles à accourir lorsqu'on claque dans les mains[13]. Le miro rubisole est un oiseau territorial, surtout en période de reproduction. Lorsqu'il est agressif, principalement avec les autres oiseaux, il hérisse les plumes de sa tête. Avec d'autres espèces, notamment les humains, il montre le point blanc sur sa tête[8]. Le miro rubisole occupe la même niche écologique que celle du rouge-gorge en Europe[11].
Cognition numérique
Selon une étude sur la cognition numérique chez les animaux, réalisée par des chercheurs de l'Université Victoria, les miros rubisoles vivant dans la nature sont capables de discriminer différentes quantités de vers. Les miros rubisoles ont démontré la capacité à différencier et hiérarchiser des caches de différentes tailles, jusqu'à douze, au total, sans aucun entraînement. En fait, ces miros ont la plus haute compétence numérique parmi toutes celles enregistrées pour des animaux sauvages. Ils l'utilisent pour retrouver les plus grandes caches d'abord, avant celles qui sont moins gratifiantes[29].
Alimentation
Les invertébrés, notamment les insectes, les vers de terre, les araignées, les cigales, les escargots, les scarabées et autres arthropodes, constituent la majeure partie du régime alimentaire des miros rubisoles[30]. Ils recherchent ces derniers dans la litière de feuilles couvrant le sol de leur habitat. Ils ont également été observés en train de manger des baies, de temps à autre, notamment au printemps et en automne[8] - [11], mais ils n'en stockent pas dans des caches. Ils le font, par contre, avec les invertébrés, stockant leur proie entière ou en morceaux. Ils le font individuellement, sur différents sites, mais ne font pas plus d'une cache sur un site particulier. Ils stockent généralement leurs proies à une dizaine de mètres de l'endroit où ils les ont tuées, même s'ils ne sont pas sur leur propre territoire.
En hiver, ils stockent principalement des vers de terre, et, pendant l'été, des cigales. Ils se souviennent très bien de leurs sites de stockage. Un mâle a été observé en train d'ouvrir successivement cinq caches, avant d'en rapporter le contenu à sa compagne, pendant l'incubation[31]. Après un stockage, un miro retourne généralement à la chasse, à moins qu'une proie particulièrement importante n'ait été capturée et stockée. Dans ce cas, il lisse son plumage ou se repose pendant un certain temps. Habituellement, les miros ne reviennent pas à une cache donnée, si plus de quatre jours se sont écoulés depuis la mise à mort. L'exception, rare, est celle d'un ver de terre, que le miro peut récupérer après plusieurs jours. En raison de son taux métabolique élevé, un miro peut passer jusqu'à 90 % de sa journée à se nourrir ou à stocker pendant l'hiver[31].
Outre la recherche d'invertébrés sur le sol de la forêt, un miro rubisole consacre aussi du temps à glaner dans la végétation (4,5 % du temps), à chasser à l'affut, à partir d'une branche basse, d'un rocher ou d'une souche (0,3 % du temps)[8] - [11] ou à gober les mouches (0,1 % du temps), afin de trouver de la nourriture[30]. En dehors de la collecte des ressources alimentaires, un miro rubisole participe également à quelques activités de soin du corps pendant la journée. Il consacre environ 0,5 % de son temps à se baigner et 0,04 % à attraper des fourmis ou des mille-pattes, qu'il mange parfois ensuite. Certains adultes prennent des bains de soleil, même si ce comportement ne semble pas être essentiel, car les juvéniles ne le pratiquent pas du tout[32]. Le miro rubisole vit relativement longtemps, jusqu'à 14 ans, là où les prédateurs sont peu ou pas du tout présents[33].
Reproduction
Les miros rubisoles sont génétiquement monogames et la paternité hors du couple est rare. Comme ils restent généralement monogames, ne sont pas migrateurs, et restent sur leurs territoires de reproduction toute l'année, un mâle et une femelle sont en compétition pour les ressources alimentaires, sur ce territoire, en dehors des périodes de reproduction. Comme ils utilisent des méthodes légèrement différentes pour se nourrir, cette concurrence est légèrement réduite. Toutefois, ils peuvent voler dans les caches de leur partenaire, si on leur en donne l'occasion[31].
Les mâles dominent les femelles et excluent donc celles-ci, de manière agressive, des ressources alimentaires, de sorte que les femelles n'ont accès à ces ressources que lorsqu'elles ne sont pas surveillées par les mâles[34]. Au cours de la saison de reproduction, la femelle est seule responsable de la construction du nid et de l'incubation. Le mâle apporte alors la nourriture à la femelle et aux nouveau-nés[23]. Par conséquent, les mâles stockent moins que les femelles, durant cette période, mais plus que les femelles, hors des périodes de reproduction (le taux de stockage des femelles reste stable tout au long de l'année)[34].
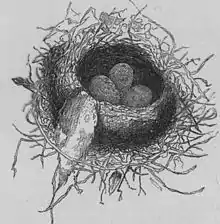
En matière de reproduction, les miros rubisoles ont des caractéristiques assez intéressantes, qui les aident, dans une certaine mesure, à compenser la prédation. Les miros rubisoles deviennent sexuellement mûrs entre six et douze mois. Ils commencent leur saison de reproduction assez tôt, entre juillet et septembre, en s'aidant de leurs réserves d'alimentation, sinon ils auraient à dépenser trop de temps à la recherche de nourriture, en ce début de printemps[31]. La femelle construit, en cinq jours, un nid, en forme de coupe ouverte, dans les fourches des arbres, près du tronc[8], ou dans des cavités à l'intérieur d'arbres[6]. Le nid est fait de brindilles, d'herbes, de mousses et d'écorces, maintenus ensemble avec des toiles d'araignée, mais les miros rubisoles utilisent souvent un ancien nid d'un autre oiseau. Une couvée comporte deux à quatre œufs. La taille modale est de deux œufs, avec les choix attendus entre la taille et le nombre d'œufs observés (plus la taille est importante, moins il y a d'œufs)[33] - [35]. Les œufs sont de couleur crème avec des taches brunes.
L'incubation a lieu en octobre et novembre et dure 17 à 19 jours et les poussins quittent le nid au bout de 19 à 21 jours. Ils restent, cependant, alimentés par les parents (surtout le mâle) entre 25 et 50 jours après leur émancipation[8].
Cinq à 25 jours après que les oisillons ont quitté le nid, le couple peut se reproduire à nouveau. Comme les femelles restent dans le nid avec les nouveau-nés pendant longtemps, elles et les petits sont vulnérables à la prédation. Si la femelle survit à une attaque par un prédateur, cependant, elle et son compagnon peuvent se reproduire plus rapidement (trois à dix jours) que lorsqu'une couvée normale quitte le nid, ce qui rend un peu plus facile la compensation de la prédation[23]. La saison de reproduction s'étend de juillet à janvier, pendant laquelle il peut y avoir jusqu'à quatre nichées, six si certaines échouent.
Chant
Hors de la saison de reproduction, le chant du mâle est clair et fort. Il consiste en une série de notes, de fréquence décroissante, qui commencent en succession rapide, pour finir lentement. Son appel est un doux « chirp ». Au cours de la saison de reproduction, entre août et décembre, les mâles émettent un chant complet pour faire la cour aux femelles[8]. C'est un chant puissant, clair et continu, qui peut durer plus de 30 minutes, avec de très brèves pauses. Il est généralement chanté du haut de la canopée ou d'un arbre émergent[23]. Le chant est aussi, apparemment, émis dans le cadre d'une régulation stratégique de la masse corporelle. Alors que les miros rubisoles chantent pendant le chœur du matin, ainsi que durant toute la journée, ils semblent accroître leur chant en fonction de la disponibilité de nourriture. Quand ils ont eu plus de nourriture, ils vont favoriser les comportements énergétiques, tel que le chant, dans le but d'arriver à une masse stratégique au crépuscule. Ainsi, même si deux miros rubisoles peuvent commencer la journée avec des masses différentes, celles-ci vont être similaires à la fin de la journée. Un effet secondaire de ce comportement peut être la mise en valeur de la capacité d'un mâle particulier à piéger des ressources : plus il chante, plus il est capable de trouver de la nourriture, et donc meilleur candidat il est, en tant que partenaire[28].
Évolution
Les résultats de phylogénie moléculaire suggèrent qu'il y a eu deux vagues successives du genre Petroica, venues d'Australie. La première vague produit Petroica longipes et Petroica australis, alors que la seconde donne naissance à Petroica macrocephala. De plus, ces résultats suggèrent que les deux espèces, installées sur les îles du Nord et du Sud (en y incluant Stewart), commencent à diverger à l'ère Pléistocène et que les deux espèces restantes sont les seules à avoir survécu aux cycles de glaciations du Pléistocène. La divergence de 5,9 % des séquences génétiques de certaines parties du génome mitochondrial, entre les espèces du nord et du sud, indiquent une durée de séparation d'environ trois millions d'années[7]. Ceci contraste avec les quelque 10 000 ans (depuis la dernière glaciation) écoulés depuis la séparation entre Petroica australis australis et Petroica australis rakiura.
Des fossiles de miros rubisoles se rencontrent parfois près de restes de pièges, car ces oiseaux recherchent leur nourriture et s'alimentent essentiellement au sol[30]. Ces fossiles montrent la présence des miros dans toutes les basses terres de Nouvelle-Zélande, jusqu'à ce qu'intervienne une réduction drastique de leur habitat par déforestation, effectuée aussi bien par les Polynésiens que les colonisateurs européens[4].
Philatélie
La Nouvelle-Zélande a émis un timbre représentant un miro rubisole[36].
Notes
- .
- Henri Jouan, Essai sur la faune de la Nouvelle-Zélande, Paris et Cherbourg (France), J. P. Baillière et fils - Bedelfontaine et Syffert, , 113 p. (lire en ligne), « Gobe-Mouche rubisole », p. 25.
- .
- (en) Kerry M. Borkin, « South Island robin (Petroica australis australis) abundance and leaf-litter invertebrates in plantation and native forest », Notornis, vol. 54, no 2, , p. 65.
- .
- (en) K. E. Steffens, « Habitat selection by South Island saddlebacks and Stewart Island robins reintroduced to Ulva Island, New Zealand », Journal of Ecology, vol. 29, , p. 221—229.
- (en) Hilary C. Miller et David M. Lambert, « A molecular phylogeny of New Zealand’s Petroica (Aves: Petroicidae) species based on mitochondrial DNA sequences », Molecular Phylogenetics and Evolution, vol. 40, no 3, , p. 844—855 (DOI 10.1016/j.ympev.2006.04.012, résumé).
- (en) B. Heather et H. Robertson, The Field Guide to the Birds of New Zealand, Penguin Books, , 440 p. (ISBN 978-0-14-302040-0).
- (en) R. J. Laws et Ian G. Jamieson, « Is lack of evidence of inbreeding depression in a threatened New Zealand robin indicative of reduced genetic load? », Animal Conservation, vol. 14, no 1, , p. 47.
- (en) K. A. Hale et J. V. Briskie, « Decreased immunocompetence in a severely bottlenecked population of an endemic New Zealand bird », Animal Conservation, vol. 10, no 1, , p. 2—10.
- (en) T. Lindsey et R. Morris, Field Guide to New Zealand Wildlife, HarperCollins Publishers, , 263 p. (ISBN 978-1-86950-300-0).
- .
- Pas si miro que ça… « Les copains d'abord.
- (en) Sabrina S. Taylor, « Genetic monogamy in two long-lived New Zealand passerines », Journal of Avian Biology, vol. 39, no 5, , p. 579—583.
- (en) E. Spurr et T. L. Montague (dir.), The brushtail possum : biology, impact and management of an introduced marsupial, Lincoln, Manaaki Whenua Press, , « Impacts of possum control on non-target species ».
- (en) Evaluating the use of 1080 : Predators, poisons and silent forests, Parliamentary Commissioner for the Environment (présentation en ligne).
- (en) Ralph Graham Powlesland, J. W. Knegtmans et I. S. J. Marshall, « Costs and benefits of aerial 1080 possum control operations using carrot baits to North Island robins (Petroica australis longipes), Pureora Forest Park », New Zealand Journal of Ecology, New Zealand Ecological Society, vol. 23, no 2, , p. 149—159 (lire en ligne).
- TVNZ.
- (en) Robert B. Schadewinkel et Ian G. Jamieson, The effect of aerial application of 1080 cereal baits for possum control on South Island robin (Petroica australis) in the Silver Peaks, Dunedin (lire en ligne).
- « Muscicapa, fronte, abdomine mediâ alarum parte, exterioribus rectricibusque albis, aliis partibus corporis, rostro pedibusque nigris, infrà pedes colore cinnabari ».
- .
- .
- (en) Ralph Graham Powlesland, Protocols for monitoring New Zealand robins (Petroica australis), vol. 13, Wellington (Nouvelle-Zélande), Department of Conservation, coll. « Department of Conservation Technical Series » (no 13), , 14 p. (ISBN 0-478-01963-7, ISSN 1172-6873, lire en ligne).
- Liste rouge de l'Union internationale pour la conservation de la nature.
- .
- (fr+en) Référence ITIS : Petroica australis (Sparrman, 1788).
- (en) Référence UICN : espèce Petroica australis (Sparrman, 1788).
- (en) Craig A. Barnett et James V. Briskie, « Strategic Regulation of Body Mass and Singing Behavior in New Zealand Robins », Ethology, vol. 117, no 1, , p. 28.
- (en) Simon Hunt, Jason Low et K.C. Burns, « Adaptive numerical competency in a food-hoarding songbird », Royal Society of London. Proceedings, biological Sciences, vol. 275, no 1649, , p. 2373—2379.
- (en) Trevor H. Worthy et Richard N. Holdaway, The Lost World of the Moa, , « Shorebirds, Parrots and Passerines », p. 410—440.
- (en) Ralph Graham Powlesland, « Food-Storing Behavior of the South Island Robin », Mauri Ora, vol. 8, , p. 11.
- (en) Ralph Graham Powlesland, « Body maintenance activities of the South Island robin », Emu, vol. 82, , p. 296.
- (en) S. S. Taylor, « Historic and contemporary levels of genetic variation in two New Zealand passerines with different histories of decline », Journal of Evolutionary Biology, vol. 20, no 5, , p. 2035.
- (en) Jamie Steer et K. C. Burns, « Seasonal variation in male-female competition, cooperation and selfish hoarding in a monogamous songbird », Behavioral Ecology & Sociobiology, vol. 62, no 7, , p. 1175.
- (en) Rebecca L. Boulton et Ralph Graham Powlesland, « Variation in egg size and nest survival with female age in the South Island Robin Petroica australis », Ibis, vol. 150, no 4, , p. 824.
- .
Références
- (en) C. J. R. Robertson, Reader's Digest Complete Book of New Zealand Birds, Reader's Digest, .
- (ru) Р. Л. Бёме, В. Е. Флинт et В. Е. Соколова (dir.), Пятиязычный словарь названий животных. Птицы. Латинский, русский, английский, немецкий, французский, (ISBN 5-200-00643-0), p. 355.
- (es) F. Bernis, E. De Juana, J. Del Hoyo, M. Fernández-Cruz, X. Ferrer, R. Sáez-Royuela et J. Sargatal, « Nombres en castellano de las aves del mundo recomendados por la Sociedad Española de Ornitología : (Duodécima parte: Orden Passeriformes, Familias Picathartidae a Paridae) », Ardeola, vol. 56, no 1, , p. 127—134.
Voir aussi
Articles connexes
Liens externes
- (fr) Référence Oiseaux.net : Petroica australis (+ répartition)
- (en) Référence Congrès ornithologique international : (consulté le ).
- (en) Référence UICN : espèce Petroica australis (Sparrman, 1788) (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Petroica australis dans Petroicidae .
- (en) Référence Tree of Life Web Project : Petroica australis .
- (en) Référence Catalogue of Life : Petroica australis (Sparrman, 1788) (consulté le ).
- (fr+en) Référence Avibase : Petroica australis (+ répartition).
- (en) Référence Paleobiology Database : Petroica australis (Sparrman 1788) .
- (en) Référence Animal Diversity Web : Petroica australis.
- (en) Référence NCBI : Petroica australis (taxons inclus).
- (en) Département de la protection.
- (en) Te Ara.
- (en) .
- (en) Petroicidae.
