Hypertrophie ventriculaire droite
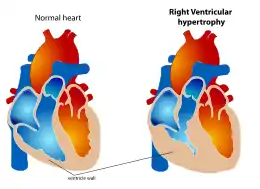
L'hypertrophie ventriculaire droite (HVD) est une affection définie par un élargissement anormal du muscle cardiaque entourant le ventricule droit. Le ventricule droit est l'une des quatre chambres du cœur. Il se situe vers le bas du cœur et reçoit le sang de l'oreillette droite et le pompe vers les poumons.
| Spécialité | Cardiologie |
|---|
![]() Mise en garde médicale
Mise en garde médicale
Puisque l'HVD est un élargissement du muscle, il survient lorsque le muscle doit travailler plus fort. Par conséquent, les causes principales de l'HVD sont des pathologies de systèmes liés au ventricule droit, telles que l'artère pulmonaire, la valvule tricuspide ou les voies respiratoires. L'HVD est le plus souvent secondaire à des pathologies respiratoires qui, du fait de leur gravité ont un retentissement cardiaque.
L'HVD peut être bénigne et avoir peu d'impact sur la vie quotidienne ou au contraire, conduire à des conditions telles que l'insuffisance cardiaque, dont le pronostic est sombre.
Symptômes et signes
Symptômes
Bien que les présentations varient, les personnes atteintes d'hypertrophie ventriculaire droite peuvent présenter des symptômes associés à une hypertension pulmonaire, une insuffisance cardiaque et/ou une diminution du débit cardiaque. Ceux-ci sont notamment[1] - [2] :
- Difficulté à respirer à l'effort
- Douleur thoracique (angine de poitrine) à l'effort
- Évanouissement (syncope) à l'effort
- Asthénie / léthargie
- Vertiges
- Sensation de plénitude dans la partie supérieure de l'abdomen
- Malaise ou douleur dans l'abdomen supérieur droit
- Réduction de l'appétit (anorexie)
- Gonflement (œdème) des jambes, des chevilles ou des pieds
- Palpitations
Signes
Lors de l'inspection, les patients peuvent être atteints d'une maladie chronique, cyanosée, cachectique et occasionnellement ictérique.
À l'examen physique, les caractéristiques les plus importantes sont dues au développement de l'insuffisance cardiaque du côté droit. Ceux-ci peuvent inclure une pression veineuse jugulaire élevée, une ascite, un soulèvement parasternal gauche et un foie douloureux et hypertrophié à la palpation[3]. Le soulèvement parasternal est une impulsion précordiale qui peut être palpée. Les impulsions précordiales sont des pulsations visibles ou palpables de la paroi thoracique, qui proviennent du cœur ou des grands vaisseaux.
Lors de l'auscultation, un deuxième bruit pulmonaire accentué (B2), un troisième bruit cardiaque appelé «galop ventriculaire droit» (B3), ainsi qu'un souffle systolique sur la région tricuspide accentuée par l'inspiration peuvent être présents. À l'occasion, le souffle systolique peut être transmis et ausculté au niveau du foie. Moins typiquement, le souffle diastolique peut également être entendu à la suite d'une insuffisance pulmonaire[3].
Les causes
L'HVD est généralement due à une maladie pulmonaire chronique ou à des défauts structurels du cœur. L'hypertension artérielle pulmonaire[3] définie comme une augmentation de la pression artérielle dans les vaisseaux pulmonaire, est l'une des causes les plus courantes d'HVD. Le ventricule droit tente de compenser cette pression accrue en modifiant sa forme et sa taille. L'hypertrophie des myocytes entraîne une augmentation de l'épaisseur de la paroi du ventricule droit. L'incidence mondiale d'hypertension artérielle pulmonaire est de 4 par million d'habitants[4]. L'HVD survient dans environ 30% de ces cas.
Les causes courantes de l'hypertension pulmonaire comprennent la bronchopneumopathie chronique obstructive (BPCO), l'embolie pulmonaire et d'autres maladies pulmonaires restrictives. L'HVD est souvent le résultat de ces troubles. On observe une HVD chez 76% des patients atteints de BPCO avancée et chez 50% des patients présentant une maladie pulmonaire restrictive[3].
L'HVD survient également en réponse à des défauts structurels du cœur. Une cause fréquente est l'insuffisance tricuspide. Il s'agit d'un trouble dans lequel la valve tricuspide ne se ferme pas correctement, ce qui cause un reflux sanguin. La tétralogie de Fallot, les malformations du septum ventriculaire, la sténose de la valve pulmonaire et les malformations du septum auriculaire sont d'autres défauts structurels qui entraînent une HVD[5]. L'HVD est également associée à l'obésité abdominale, à une glycémie élevée à jeun, à une pression artérielle systolique élevée et à un raccourcissement fractionnel de la paroi médiane du ventricule gauche. Dans une petite étude, l'HVD a été diagnostiquée chez un tiers des personnes souffrant d'hypertension essentielle[6].
Le tabagisme, l'apnée du sommeil et une activité physique intense sont d'autres facteurs de risque pour l'HVD. Celles-ci augmentent le risque de maladies cardiaques et pulmonaires et donc d'HVD[7].
Physiopathologie
L'hypertrophie ventriculaire droite peut être à la fois un processus physiologique et physiopathologique. Cela devient physiopathologique (nuisible) en cas d'hypertrophie excessive. Le processus physiopathologique se produit principalement par la signalisation aberrante des hormones neuroendocrines ; l'angiotensine II, l'endothéline-1 et les catécholamines (par exemple la noradrénaline).
Angiotensine-II et endothéline-1
L'angiotensine-II et l'endothéline-1 sont des hormones qui se lient aux récepteurs de l'angiotensine et de l'endothéline. Ce sont des récepteurs couplés aux protéines G qui agissent via des voies de signalisation internes. À travers plusieurs intermédiaires, ces voies de signalisation augmentent directement ou indirectement la production de dérivés réactifs de l'oxygène (DRO) provoquant leur accumulation dans les cellules du myocarde. Cela peut induire par la suite une mort cellulaire nécrotique, une fibrose et un dysfonctionnement mitochondrial[8].
Cela a été démontré dans des études sur des animaux. La protéine kinase C (PKC) est une molécule intermédiaire de la voie de signalisation. Les souris dépourvues de PKC présentaient une résistance à l'insuffisance cardiaque par rapport aux souris surexprimant la PKC, qui présentaient un dysfonctionnement cardiaque[9].
Le ciblage du système rénine-angiotensine (SRAA) (utilisant des inhibiteurs de l'enzyme de conversion de l'angiotensine et des antagonistes des récepteurs de l'angiotensine) constitue une approche clinique reconnue pour inverser l'hypertrophie cardiaque pathologique indépendamment de la pression artérielle.
Catécholamines
La quantité des catécholamines augmentent en raison de l'activité accrue du système nerveux sympathique. Les catécholamines peuvent agir sur les récepteurs alpha-adrénergiques et les récepteurs bêta-adrénergiques, qui sont des récepteurs couplés aux protéines G. Cette liaison initie les mêmes voies de signalisation intracellulaires que l'angiotensine et l'endothéline. Il existe également une activation de l'AMPc et une augmentation du Ca2 + intracellulaire, ce qui entraîne un dysfonctionnement contractile et une fibrose[8].
Autres
Les hormones ne sont pas la seule cause de l'HVD. L'hypertrophie peut également être provoquée par des forces mécaniques avec les voies mTOR, l'oxyde nitrique et les cellules immunitaires. Les cellules immunitaires peuvent provoquer une hypertrophie en induisant une inflammation[8].
Diagnostic

.jpg.webp)
Les deux principaux tests de diagnostic utilisés pour confirmer l'hypertrophie ventriculaire droite sont l'électrocardiogramme et l'échocardiographie.
Électrocardiographie
L'utilisation de l'électrocardiogramme (ECG) pour mesurer l'hypertrophie de la chambre cardiaque est bien établie, mais comme l'activité ventriculaire gauche est dominante sur l'ECG, une HVD importante est requise pour tout changement détectable. Néanmoins, l'ECG est utilisé pour aider au diagnostic de l'HVD. Une étude post mortem portant sur 51 patients masculins adultes a abouti à la conclusion que l'on pouvait diagnostiquer une HVD anatomique en utilisant un ou plusieurs des critères ECG suivants[10] :
- Déviation d'axe droit supérieure ou égale à 110° (voir le chiffre de référence hexaxial)
- Onde R dominante sur l'onde S dans V1 ou V2
- Onde S dominante sur l'onde R dans V6
Cependant, l'American Heart Association a recommandé l'utilisation de tests de diagnostic supplémentaires pour diagnostiquer l'HVD, car aucun critère unique ou ensemble de critères n'a été considéré comme suffisamment fiable[11].
Échocardiographie
L'échocardiographie peut être utilisée pour visualiser directement l'épaisseur de la paroi du ventricule droit. La technique privilégiée est l'approche trans-œsophagienne donnant une vue sur les 4 chambres. L'épaisseur normale d'une paroi libre du ventricule droit varie de 2 à 5 millimètres, avec une valeur supérieure à 5 mm considérée comme hypertrophique[12].
Traitement
Il est important de comprendre que l'hypertrophie ventriculaire droite n'est pas le problème principal en soi, le problème est ce qui cause l'hypertrophie ventriculaire droite. L'hypertrophie ventriculaire droite est le stade intermédiaire entre l'augmentation de la pression ventriculaire droite (aux premiers stades) et la défaillance du ventricule droit (aux derniers stades)[13]. En tant que telle, la gestion de l'hypertrophie ventriculaire droite vise à prévenir l'aggravation de l'hypertrophie ventriculaire droite en premier lieu, ou à empêcher la progression vers l'insuffisance du ventricule droit. L'hypertrophie ventriculaire droite, en elle-même, n'a pas de traitement pharmacologique[7].
Traiter la cause
Comme la cause principale de l'hypertrophie ventriculaire droite est une régurgitation tricuspide ou une hypertension artérielle pulmonaire (voir plus haut), la prise en charge implique le traitement de ces affections[3]. La régurgitation tricuspide est généralement traitée de manière conservatrice en visant à traiter la cause sous-jacente et en suivant régulièrement le patient[14]. La chirurgie cardiaque est envisagée dans les situations plus graves où le patient est gravement symptomatique. Les options chirurgicales comprennent : le remplacement de la valve ou la réparation de la valve (appelée annuloplastie). En ce qui concerne le remplacement, vous avez le choix entre une valve bioprothétique ou une valve mécanique, en fonction des caractéristiques du patient. La valve mécanique a une plus grande durabilité, mais nécessite une anti-coagulation pour réduire le risque de thrombose. Le traitement de l'hypertension artérielle pulmonaire sera étiologique. De plus, les éléments suivants peuvent également être pris en compte : traitement par un diurétique, par l'oxygène et par un anticoagulant.
Gérer les complications
Après une période prolongée, le ventricule droit ne parvient plus à s'adapter suffisamment pour pomper face à une pression accrue, c'est alors le stade de l'insuffisance ventriculaire droite. Cette insuffisance ventriculaire droite est la principale complication de l'hypertrophie ventriculaire droite. Les mécanismes sous-jacents de la progression de l'hypertrophie vers l'insuffisance ne sont pas bien compris[13] et la meilleure gestion consiste à réduire / minimiser les facteurs de risque d'aggravation. Les changements de mode de vie peuvent aider à réduire le risque de cette progression[5]. Les changements de style de vie incluent : manger des aliments moins salés car la consommation de sel conduit à une plus grande rétention d'eau par le corps; le sevrage tabagique; éviter la consommation excessive d'alcool car l'alcool réduit la force des contractions cardiaques. Une fois que l'hypertrophie ventriculaire droite progresse jusqu'à l'insuffisance ventriculaire droite, le traitement devient celui de l'insuffisance cardiaque. En bref, cela inclut l'utilisation de :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Right ventricular hypertrophy » (voir la liste des auteurs).
- « Pulmonary Hypertension », nhs.uk, NHS, (consulté le )
- Ibrahim, « Right Ventricular Failure », e-Journal of Cardiology Practice, vol. 14, no 32, (lire en ligne, consulté le )
- Bhattacharya et Sharma, « Right Ventricular Hypertrophy », StatPearls, NCBI, (consulté le )
- Oudiz, « Idiopathic Pulmonary Arterial Hypertension », Medscape, (lire en ligne, consulté le )
- « Understanding Right Ventricular Hypertrophy », Healthline, (consulté le )
- Cuspidi et Negri, « Prevalence and clinical correlates of right ventricular hypertrophy in essential hypertension », Journal of Hypertension, vol. 27, no 4, , p. 854–860 (PMID 19516183, DOI 10.1097/HJH.0b013e328324eda0, lire en ligne, consulté le )
- Johnson, « What is right ventricular hypertrophy? », Medical News Today, (consulté le )
- Nakamura et Sadoshima, « Mechanisms of physiological and pathological cardiac hypertrophy », Nature Reviews Cardiology, vol. 15, no 7, , p. 387–407 (PMID 29674714, DOI 10.1038/s41569-018-0007-y)
- Braz et Gregory, « PKC-α regulates cardiac contractility and propensity toward heart failure », Nature Medicine, vol. 10, no 3, , p. 248–254 (PMID 14966518, DOI 10.1038/nm1000)
- Lehtonen, « Electrocardiographic Criteria for the Diagnosis of Right Ventricular Hypertrophy Verified at Autopsy », Chest, vol. 93, no 4, , p. 839–42 (PMID 2964996, DOI 10.1378/chest.93.4.839)
- Hancock, « AHA/ACCF/HRS Recommendations for the Standardization and Interpretation of the Electrocardiogram », Journal of the American College of Cardiology, vol. 53, no 11, , p. 992–1002 (PMID 19281932, DOI 10.1016/j.jacc.2008.12.015)
- Ho, « Anatomy, echocardiography, and normal right ventricular dimensions », Heart, vol. 92, no Supp 1, , i2–i13 (PMID 16543598, PMCID 1860731, DOI 10.1136/hrt.2005.077875)
- van der Bruggen, « RV pressure overload: from hypertrophy to failure », Cardiovascular Research, vol. 113, no 12, , p. 1423–1432 (PMID 28957530, DOI 10.1093/cvr/cvx145)
- « Tricuspid Regurgitation », BMJ Best Practice, BMJ, (consulté le )