Hippolyte inermis
Hippolyte inermis, la crevette d'herbiers selon l’INPN ou grande Hippolyte d'herbier[2] ou encore Hippolyte d'herbier, noms également parfois donnés à une espèce proche : Hippolyte varians[3].


NE : Non évalué
- Alpheus elongatus Risso, 1827
- Alpheus viridis Otto, 1821
- Carida viridis Rafinesque, 1814
- Hippolyte mauritanicus Lucas, 1846
- Hippolyte mitchelli W. Thompson, 1853
- Hippolyte producta Norman, 1861
- Hippolyte virescens H. Milne Edwards, 1837 [in H. Milne Edwards, 1836-1844]
- Hippolyte whitei W. Thompson, 1853
- Hippolyte whitei var. ensis W. Thompson, 1853
- Hippolyte whitei var. falcatus W. Thompson, 1853
- Hippolytus brullei Guérin, 1832
- Palemon margaritaceus Risso, 1816
- Palemon olivieri Risso, 1816
- Virbius brullei (subsequent combination for Hippolytus brullei Guérin, 1832)
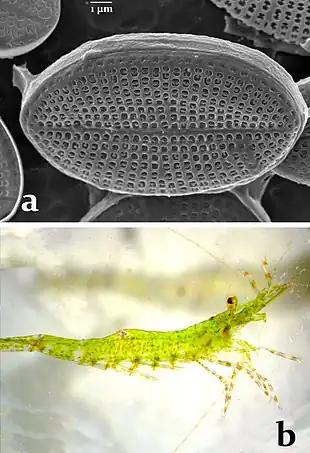
C'est une petite crevette (4 cm max), souvent d'un vert intense mais qui peut adopter d'autres couleurs et divers motifs de camouflage. Elle peut potentiellement être observée sur tout le littoral français, près du trait de côte et dans les herbiers[3] et plus largement dans une grande partie des eaux marines européennes.
Histoire scientifique
Cette espèce a été décrite par William Elford Leach en 1816[4] peu après qu’il a créé le genre Hippolyte et décrit une première espèce (l’hippolyte variable) qui ressemble beaucoup à H. inermis.
La capacité de cet animal à changer de couleur, mimétiquement pour mieux se fondre dans son environnement a beaucoup intrigué les naturalistes depuis le XIXe siècle au moins et a fait l’objet de quelques études (de pigments et chromatophores et des mécanismes de camouflage). Une autre question scientifique aujourd'hui résolue a été de savoir si l'espèce était ou non hermaphrodite.
Habitats et répartition géographique
Ce petit crustacé vit en Atlantique-ouest, Manche et mer du Nord, et en Méditerranée ; principalement dans les herbiers marins de posidonies (Posidonia oceanica) et de zostères (Zostera marina)[5] et jusque dans certains estuaires[6].
Description
Taille : cet animal atteint 4 cm à l’âge adulte.
Forme : à la différence d’Hippolyte varians, cette crevette ne présente pas de bosse très marquée au niveau du dos ; de profil, elle apparait plus rectiligne et elle est en outre un peu plus grande que H. varians (chez l’adulte).
Dimorphisme sexuel : cette espèce présente un certain dimorphisme sexuel au moins en termes de taille et peut-être de couleur[7]. Les mâles sont en moyenne un peu plus petits. L’abdomen des femelles est souvent gonflé d’œufs ou de zoeae.
Cette crevette a souvent été présentée par la littérature comme hermaphrodite protandre (c'est-à-dire que le mâle peut changer de sexe et devenir femelle, comme d’autres espèces de cette famille)[8]. Ceci a été mis en doute en 2005 par Cobos & al. qui n’ont pas trouvé chez l’espèce de signe de protandrie en étudiant finement les organes génitaux de cette espèce à divers stade de croissance et conclut que l’espèce est au contraire gonochorique [9]), puis il a été démontré que l’absorption de certaines diatomées Cocconeis sp. pouvait déclencher l'apparition de femelles primaires (par apoptose à la fois des gonades mâles et des cellules des glandes androgéniques chez les postlarves. Cet effet semble spécifique à cette espèces et strictement localisée à la gonade mâle et de la glande androgène, et limitée à une très courte période de temps (du 5e au 12e jour du développement postlarvaire)[10] - [11]. Comme ces changements de sexes n’interviennent qu’avant la première reproduction et jamais chez l’adulte, la structure de la population est in fine de type gonochorique [5].
Couleur : elle peut considérablement varier : rouge, verte, jaunâtre ou brune (avec des effets de transparence ou non) selon son milieu de vie ou l'heure de la journée. Ses chromatophores peuvent simuler des taches irrégulières de couleur rose-mauve évoquant les algues rouges encroûtantes qui croissent dans son environnement[2].
Durée de vie : en Espagne une étude a montré que les mâles vivent moins longtemps (8 mois) que les femelles (12 mois environ)[5], et dans cette même région, le sex-ratio est en faveur des femelles, tout au long du cycle de vie[5].
Variations de couleurs, mimétisme
La physiologie[12] et les causes des changements de coloration de cette crevette semblent être du même type que pour l'espèce voisine Hippolyte varians que les scientifiques ont beaucoup étudié de ce point de vue, et depuis 150 ans au moins[13] - [14] - [15] ; des pigments et un système sophistiqué de chromatophores permettent des changements de couleur et d’intensité (de jour et de nuit, y compris chez les larves). Plusieurs auteurs ont estimé que le système hormonal jouait aussi un rôle dans les cycles temporels de coloration (avec une hormone qui serait produite dans le pédoncule oculaire[16]).
Risques de confusion
Elle peut être très facilement confondue avec d'autres espèces du même genre, et en particulier avec une espèce proche (Hippolyte varians) qui est un peu plus petite (au même âge) et qui en outre présente un aspect moins "bossu" (plus linéaire).
Comportement
Le jour Hippolyte inermis se cache parmi les algues et les roches, dans des habitats spécifiques dont elle ne s’éloigne pas, et où grâce à ses capacités de camouflage elle est très discrète.
Dans l'environnement nocturne, tout comme d’autres crevettes apparemment inféodées à un habitat spécifique (ex : Eualus gaimardii et Lebbeus polaris)[17], elle peut, à la recherche de diatomées, s’éloigner des zones d’où elle ne s’absente normalement pas le jour.
Chémotactisme
Cette espèce, comme toutes les autres crevettes est probablement capable de détecter certains métabolites libérés dans l’environnement marin[18] par les microalgues qu’elle recherche comme nourriture (dont les diatomées de type Cocconeis[19]).
État des populations, pressions, menaces
Le statut de cette espèce n’a pas fait l’objet d’évaluations fines, même si elle a fait l’objet de quelques études de dynamique de populations[5].
Elle est vulnérable à certains polluants marins, dont par exemple les métaux lourds ou métalloïdes[20]
Tout comme l’espèce voisine H. varians, elle fait partie des crevettes originales susceptibles d’être recherchées pour l’aquariophilie, notamment à la suite de la dégradation générale des écosystèmes coralliens qui poussent certains marchands à se tourner vers des espèces d’herbiers européens[21].
Pathologies
Comme toutes les crevettes, cette espèce peut être porteuse de parasites et de maladies bactériennes ou virales.
Elle est notamment l’hôte de parasites tels que :
Notes et références
- Fiche H inermis sur la base de données Worms des espèces marines
- Fiche H. inermis sur /www.cotebleue.org, consulté le 1er aout 2016
- Fiche INPN
- Leach W.E (1816) A tabular view of the external characters of four classes of animals, which Linné arranged under Insecta; with the distribution of the genera composing three of these classes into orders, &c. and descriptions of several new genera and species. Transactions of the Linnean Society of London. 11(2): 306-400., consultable
- Manjón-Cabeza, M. E., Cobos, V., García Muñoz, J. E., & García Raso, J. E. (2009). Structure and absolute growth of a population of Hippolyte inermis Leach 1815 (Decapoda: Caridea) from Zostera marina (L.) meadows (Malaga, southern Spain). Scientia Marina, 73(2), 377-386
- Neves, A., Cabral, H. N., & Gordo, L. S. (2007). Distribution and abundance patterns of decapod crustaceans in the Sado estuary, Portugal. Crustaceana, 80(1), 97-112.
- Turquier, Y. (1963). Sur le dimorphisme sexuel chez deux espèces de crevettes: Hippolyte varians Leach et Hippolyte leptocerus (Heller). Bull. Soc. Linn. Normandie, 4(10), 111-118
- Zupo, V. (1994). Strategies of sexual inversion in Hippolyte inermis Leach (Crustacea, Decapoda) from a Mediterranean seagrass meadow. Journal of experimental marine biology and ecology, 178(1), 131-145
- Cobos, V., Díaz, V., Raso, G., Enrique, J., & Manjón‐Cabeza, M. E. (2005). Insights on the female reproductive system in Hippolyte inermis (Decapoda, Caridea): is this species really hermaphroditic?. Invertebrate Biology, 124(4), 310-320
- Zupo, V. (2000). Effect of microalgal food on the sex reversal of Hippolyte inermis (Crustacea: Decapoda). Marine Ecology Progress Series, 201, 251-259.
- Zupo, V., Messina, P., Carcaterra, A., Aflalo, E. D., & Sagi, A. (2008). Experimental evidence of a sex reversal process in the shrimp Hippolyte inermis. Invertebrate Reproduction & Development, 52(1-2), 93-100.
- Keeble, F., & Gamble, F. W. (1904). The colour-physiology of higher Crustacea. Philosophical Transactions of the Royal Society of London. Series B, Containing Papers of a Biological Character, 196, 295-388 (résumé).
- Keeble, J. W., & Gamble, F. W. (1900). Physiologie de la coloration chez Hippolyte varians. Bull, du Muséum, 185-188
- Chassard-Bouchaud, C., & Hubert, M. (1970). Phénomènes chromatiques et rythme nycthéméral chez Hippolyte varians Leach (crustacé décapode). Experientia, 26(5), 542-543 (résumé).
- Chassard C (1961) Effets chromatiques de l’ablation des pédoncules oculaires chez les Hippolyte varians Leach (Crustacé décapode). Comptes rendus hebdomadaires des séances de l’Académie des sciences, 253(25), 3076
- Kleinholz, L. H., & Welsh, J. H. (1937). Colour changes in Hippolyte varians. Nature, 140, 851 (résumé)
- Berggren, M. (1993). Aquaria experiments on habitat choice of littoral shrimps of the Faroe Islands. Crustaceana, 65(2), 129-143
- Nappo, M., Berkov, S., Codina, C., Avila, C., Messina, P., Zupo, V., & Bastida, J. (2009). Metabolite profiling of the benthic diatom Cocconeis scutellum by GC-MS. Journal of Applied Phycology, 21(3), 295-306.
- Jüttner, F., Messina, P., Patalano, C., & Zupo, V. (2010). Odour compounds of the diatom Cocconeis scutellum: Effects on benthic herbivores living on Posidonia oceanica. Marine Ecology Progress Series, 400, 63-73.
- Untersteiner, H., Gretschel, G., Puchner, T., Napetschnig, S., & Kaiser, H. (2005). Monitoring Behavioral Responses to the Heavy Metal Cadmium in the Marine Shrimp Hippolyte inermis Leach(Crustacea: Decapoda) with Video Imaging. Zoological studies, 44(1), 71-80.
- Calado R (2006) Marine ornamental species from European waters: a valuable overlooked resource or a future threat for the conservation of marine ecosystems ? Scientia Marina, 70(3), 389-398. (PDF, 10 p)
Voir aussi
Articles connexes
Liens externes
- Bay-Nouailhat A (2007) Description de Hippolyte inermis daté d'oct. 2007, sur le site de Mer & Littoral, consulté le .
- (fr) Référence INPN : Hippolyte inermis Leach, 1815 (TAXREF)
- (en) Référence BioLib : Hippolyte inermis Leach, 1815 (consulté le )
- (en) Référence NCBI : Hippolyte inermis (taxons inclus) (consulté le )
- (en) Référence World Register of Marine Species : espèce Hippolyte inermis Leach, 1816 (consulté le )
- (fr) Référence DORIS : espèce Hippolyte inermis (consulté le )
Bibliographie
- Cobos, V., Díaz, V., Raso, J. E. G., & Manjón-Cabeza, M. E. (2010). The male reproductive system of Hippolyte inermis Leach 1815 (Decapoda, Caridea). Helgoland Marine Research, 65(1), 17.
- Espinoza-Fuenzalida, N. L., Thiel, M., Dupre, E., & Baeza, J. A. (2008). Is Hippolyte williamsi gonochoric or hermaphroditic? A multi-approach study and a review of sexual systems in Hippolyte shrimps. Marine biology, 155(6), 623-635.
- Jousson, O., Bartoli, P., & Pawlowski, J. (1999). Molecular identification of developmental stages in Opecoelidae (Digenea). International Journal for Parasitology, 29(11), 1853-1858.
- Regnault M (1969). Recherche du mode de nutrition d’Hippolyte inermis Leach (Decapoda: Caridea) au début de sa vie larvaire: structure et rôle des pièces buccales. Crustaceana, 17: 253-264.
- Regnault M (1969) Étude expérimentale de la nutrition d’Hippolyte inermis Leach (Décapoda: natantia) au cours de son développement larvaire, au laboratoire. Hydrobiology , 54: 749-764.