Erdafitinib
L'erdafitinib est une petite molécule inhibitrice du récepteur du facteur de croissance des fibroblastes (FGFR) approuvée pour le traitement du cancer. Les FGFR sont un sous-ensemble de tyrosine kinases qui ne sont pas régulées dans certaines tumeurs et influencent la différenciation, la prolifération, l'angiogenèse et la survie des cellules tumorales[3] - [4].
| Erdafitinib | |
| |
| Identification | |
|---|---|
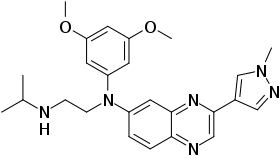
| Nom UICPA | N'-(3,5-diméthoxyphényl)-N'-[3-(1-méthylpyrazol-4-yl)quinoxalin-6-yl]-N-propan-2-yléthane-1,2-diamine |
| Synonymes |
balversa, JNJ-42756493 |
| No CAS | |
| No ECHA | 100.235.008 |
| DrugBank | DB12147 |
| PubChem | 67462786 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C25H30N6O2 |
| Masse molaire[1] | 446,544 7 ± 0,023 9 g/mol C 67,24 %, H 6,77 %, N 18,82 %, O 7,17 %, |
| Propriétés physiques | |
| Solubilité | <1 g·l-1[2] |
| Précautions | |
| SGH[2] | |
   |
|
| Données pharmacocinétiques | |
| Liaison protéique | 99,8%[2] |
| Métabolisme | 39% et 20% via cytochromes CYP2C9 et CYP3A4 respectivement[2] |
| Demi-vie de distrib. |
59 heures[2] |
| Excrétion |
fécal : 69% dont 19% non modifié et urinaire : 19% dont 13% non modifié[2] |
| Considérations thérapeutiques | |
| Classe thérapeutique | oncologie[2] |
| Voie d’administration | oral[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Efficacité
L'efficacité de l'erdafitinib a été étudiée dans un essai clinique (NCT02365597) qui a inclus 87 adultes atteints d'un cancer de la vessie localement avancé ou métastatique, avec des altérations génétiques FGFR3 ou FGFR2, qui avait progressé après un traitement par chimiothérapie[4] - [5]. Le taux de réponse global chez ces adultes était de 32,2 %, 2,3 % ayant une réponse complète et près de 30 % ayant une réponse partielle[4]. La réponse a duré en moyenne environ cinq mois et demi[4]. L'essai a été mené en Asie, en Europe et aux États-Unis[5].
Les chercheurs ont étudié l'innocuité et l'efficacité de l'erdafitinib dans le traitement du cancer des voies biliaires, du cancer gastrique, du cancer bronchique non à petites cellules et du cancer de l'œsophage[6].
L'erdafitinib a reçu une approbation accélérée[4]. D'autres essais cliniques sont nécessaires pour confirmer ; ils sont en cours ou prévus[4].
En mars 2018, l'erdafitinib a obtenu la désignation de traitement révolutionnaire de la Food and Drug Administration (FDA) des États-Unis pour le traitement du carcinome urothélial[3]. Puis, en avril 2019, l'erdafitinib a reçu l'approbation de la FDA pour le traitement du cancer de la vessie métastatique ou localement avancé avec une altération du FGFR3 ou FGFR2 qui a progressé au-delà des thérapies traditionnelles à base de platine, sous réserve d'un essai de confirmation[4] - [7].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID 67462786.
- « Janssen Announces U.S. FDA Breakthrough Therapy Designation for Erdafitinib in the Treatment of Metastatic Urothelial Cancer » [archive du ], sur Johnson & Johnson
- « FDA approves first targeted therapy for metastatic bladder cancer » [archive du ], sur U.S. Food and Drug Administration (FDA), (consulté le )
- (en) « Drug Trials Snapshots: Balversa » [archive du ], sur U.S. Food and Drug Administration (FDA), (consulté le )
- (en) Bahleda R, Italiano A, Hierro C, Mita A, Cervantes A, Chan N, Awad M, Calvo E, Moreno V, Govindan R, Spira A, Gonzalez M, Zhong B, Santiago-Walker A, Poggesi I, Parekh T, Xie H, Infante J, Tabernero J, « Multicenter Phase I Study of Erdafitinib (JNJ-42756493), Oral Pan-Fibroblast Growth Factor Receptor Inhibitor, in Patients with Advanced or Refractory Solid Tumors », Clin Cancer Res, vol. 25, no 16, , p. 4888–97 (PMID 31088831, DOI 10.1158/1078-0432.CCR-18-3334)
- (en) « Balversa (erdafitinib) Receives U.S. FDA Approval for the Treatment of Patients with Locally Advanced or Metastatic Urothelial Carcinoma with Certain FGFR Genetic Alterations » [archive du ], sur Johnson & Johnson, (consulté le )
Liens externes
- « Erdafitinib », sur Drug Information Portal, U.S. National Library of Medicine
- « Drug Approval Package: Balversa (erdafinitib) », sur U.S. Food and Drug Administration (FDA)