Echinococcus granulosus
Echinococcus granulosus ou échinocoque du chien est un très petit ténia dont l'adulte parasite l'intestin grêle du chien et dont la forme larvaire ou hydatide peut se développer chez d'autres mammifères (humain y compris) en donnant les divers tableaux de l'hydatidose, une maladie qui ne doit pas être confondue avec l'échinococcose alvéolaire (due à Echinococcus multilocularis).
L'hôte intermédiaire d' Echinococcus granulosus est souvent le mouton.
Génétique
Des données récemment acquises démontrent que le taxon E. granulosus fait preuve d'une grande diversité est en réalité un assemblage de plusieurs et assez divers génotypes[1], qui pourrait donner lieu à une révision ou précision de sous-ensembles taxonomiques[1].
Ces derniers présentent en effet des différences marquées, en termes d'épidémiologie, d'écoépidémiologie et en termes de pathogénicité pour les humains. Ceci peut aussi expliquer la répartition géographique et régionale très inégale des zones de haute endémicité pour l'Homme. Cette variation était autrefois attribué à des différences dans le comportement humain[2].
Plusieurs génotypes peuvent coexister dans une même région géographique, chez différentes animaux sauvages ou d'élevage ou domestiques (chiens, chat...). Ainsi, une étude a récemment (1999) montré en Argentine[3] - à partir de 33 isolats -la coexistence dans les élevages du pays d'au moins 4 génotypes distincts (une souche ovine commune (G1) chez le mouton de la province de Chubut et chez l'homme dans la province de Río Negro ; une souche propre au mouton de Tasmanie (G2) chez les ovins et retrouvée chez un humain de la province de Tucumán ; une souche porcine (G7) chez les porcs de la province de Santa-Fe et une la souche Carnel (G6) chez l'homme trouvée dans les provinces du Río Negro et de Buenos-Aires[3].
La mise en évidence de cette dernière souche, hébergée par les porcs et l'apparition d'une souche ovine "de Tasmanie" a « des implications considérables pour la mise en œuvre des programmes de lutte hydatiques en raison de la réduction du temps de maturation de deux souches chez le chien par rapport à la souche ovine commune »[3].
C'est la première fois que l'on trouvait des génotypes G2 et G6 chez l'homme, avec « des conséquences importantes pour la santé humaine »[3].
Une même souche portée par le chameau touche les hommes dans certaines régions et non dans d'autres, sans explications à ce jour[1].
Répartition géographique et prévalence
Cosmopolite, sa répartition mondiale exacte est mal connue, mais suit a priori celle de l'élevage du mouton, hôte intermédiaire de loin le plus fréquent (devant le bovin et le porc dans les abattoirs).
Rare en Europe et en Asie, il est très répandu en Australie, en Nouvelle-Zélande, en Afrique du Nord, dans le Middle East américain et en Argentine.
Certaines régions européennes pauvres où les médicaments anticestodiques sont moins utilisées sont plus vulnérables. À titre d'exemple en Sardaigne, une enquête a montré que les abattages domestiques sont les plus fréquents et que les abats sont donnés aux chiens (17 %) après ébullition (37 %), ou jetés à la poubelle (23 %), ou superficiellement enterrés (15 %). 69 % des éleveurs ont déclaré traiter leurs chiens mais seuls 10 % utilisaient un médicament cestodicide.
Dans ce même contexte sarde, l'analyse coprologiques d'échantillons de 300 excréments de chiens a montré une prévalence de 8 à 10 % du pathogène (E. granulosus ou E. multilocularis)[4]. Ce parasite tire son importance de la fréquence et de la gravité habituelle des atteintes humaines dans ces régions.
En Europe : E. granulosus a une répartition géographique très inégale, avec des taux de prévalence très faible dans certains des pays nordiques et d'Europe centrale[5], une endémicité moyenne dans d'autres pays ou régions et une endémicité élevé dans certaines régions du sud et de l'est de l'Europe[5]
Le foyer européen est centré sur l'Europe centrale (où « cinq souches de E. granulosus ont été identifiées (...) qui diffèrent dans leur cycle de vie ainsi que pour leur morphologie, biochimie, génétique et quelques autres aspects fonctionnels »[5]).
En France, la situation est restée longtemps mal connue. Une étude nationale de prévalence a été faite en 1989, mais uniquement via l’observation macroscopique des kystes hydatiques en abattoir (résultat : 0,13 % chez les bovins adultes, 0,42 % dans le groupe ovins-caprins (sans distinguer les espèces) et 0,009 % chez les porcins. Toute la France métropolitaine était touchée, mais le sud plus que le nord (Soulé et al. 1989).
Ensuite les vétérinaires d'abattoirs n'ont plus épidémiologiquement suivi ce pathogène, ni fait remonter d'informations à l'EFSA, faisant que les cas humains étaient en France par défaut considérés par l’InVS et le CNR Echinococcus comme des cas importés.
Puis en 2009 une nouvelle étude est lancée dans des abattoirs de dix départements du Sud de la France et en Corse. Les résultats, en 2012, ont confirmé des kystes à Echinococcus granulosus chez des animaux de rente abattus en Haute-Savoie, dans l’Hérault, dans les Alpes-de-Haute-Provence et en Corse. (prévalence dans le sud : 4 ovins pour 100 000 et 3 bovins pour 100 000 ; et en Corse à 5,4 % chez les porcs (Umhang 2013 ; Umhang 2014). Ces chiffres montrent une amélioration par rapport à vingt ans plus tôt, mais ont poussé la DGAL à lancer en 2012 un plan de surveillance national (Outre-Mer inclus) du parasite dans les viscères de bovins, ovins, porcins, caprins et équins de boucherie, avec caractérisation moléculaire[6] (par PCR et séquençage de deux gènes mitochondriaux (cox1 et nad1)[7] - [8].
Les kystes suspects sont des vésicules opaques à paroi ferme (double membrane hydatique), nettement globuleuses et renfermant un liquide sous pression contenant des protoscolex visibles sous sous loupe binoculaire) surtout trouvés sur le foie et les poumons[9].
Morphologie
C'est le plus petit des ténias d'importance médicale et vétérinaire (2 à 3 mm). Le scolex ressemble à celui de Taenia solium mais n'est suivi que de 3 anneaux, le dernier seul étant gravide.
Biologie
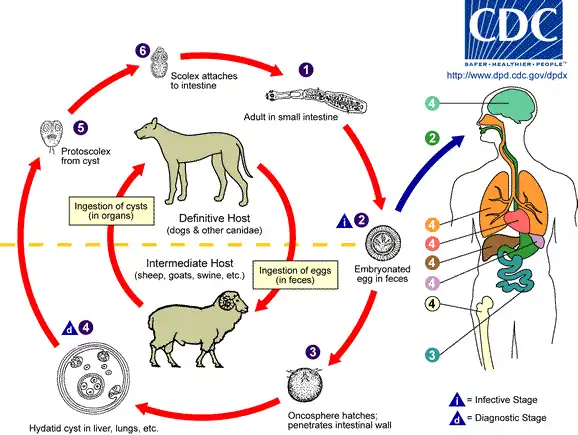
Les adultes, toujours en très grand nombre, tapissent comme un velours l'intestin grêle du chien. Les embryophores, éliminés avec les matières fécales, souillent le sol et les pâtures. Le mouton, et de nombreux autres herbivores y compris sauvages (dont le cerf par exemple[10]), s'infectent en les ingérant. Libéré par la digestion, l'embryon hexacanthe (embryon du ténia échinocoque) franchit la muqueuse digestive et migre par voie sanguine vers le foie (70 %), le poumon (20 %) et, seulement si ces deux filtres successifs ont été défaillants, vers les autres viscères.
Installé, l'embryon se développe en une larve très particulière : l'hydatide. Celle-ci se vésicule rapidement, est le siège d'une intense multiplication larvaire, bourgeonnant sur sa face interne (membrane proligère = qui porte l'agent pathogène) un grand nombre de vésicules qui baignent dans un liquide clair, salé et tendu, le liquide hydatique. À leur tour, ces vésicules proligères bourgeonnent à leur face interne des scolex, dont chacun pourra donner un ténia adulte.
Cette multiplication d'ordre 2 (1 embryon hexacanthe donnant nn' scolex) s'accompagne d'une augmentation de volume très importante, tandis qu'autour de l'hydatide, une intense réaction tissulaire va former la paroi du kyste hydatique.
C'est en mangeant les abats refusés et abandonnés sur place, des moutons que le chien s'infecte et entretient l'infection d'autant plus facilement que, même massivement parasité, c'est toujours un porteur sain. L'homme s'infecte en déglutissant quelques embryophores, soit comme souillure alimentaire, soit par l'intermédiaire des mains souillées au contact du pelage des chiens. L'importance des contacts homme-chien et chien-mouton explique le caractère souvent pastoral de l'affection.
Clinique
Trois étapes évolutives vont conditionner toute la clinique de ce "corps étranger" à la fois expansif et fragile :
- l'accroissement de volume, signe d'un "kyste sain", ne s'accompagne en général d'aucun symptôme, mais pourra à la longue entraîner des signes de compression ou même de tumeur ;
- la rencontre inévitable d'un obstacle (voie biliaire, veine cave, bronche) provoque la souffrance de l'hydatide et sa fissuration, cause d'issues liquidiennes anaphylactisantes, et parfois son infection. Cette période du "kyste malade" est la période d'état clinique ;
- la rupture est alors la conséquence à bref ou long terme. Outre le trauma local qu'elle entraîne, elle est dominée par le choc anaphylactique sévère qui l'accompagne et peut être suivie à distance de la redoutable échinococcose secondaire généralisée par dissémination dans tout l'organisme des vésicules et scolex.
Kyste hydatique du foie. Après une période de latence prolongée, pendant laquelle le kyste se développe, phase de "kyste sain", l'apparition de signes de souffrance bilaire inaugure, dans 90 % des cas, la période d'état ou phase de "kyste malade". Ces signes n'ont rien de pathognomonique et le diagnostic sera difficile devant :
- une simple dyspepsie ;
- une cholécystite capricieuse ;
- un ictère à répétition ;
- ou encore un fébricule prolongé.
Bien plus rarement, le kyste hydatique du foie se marque par un tableau de tumeur isolée. Seule une localisation antérieure permet de palper une "voussure" lisse, rénitente (qui offre une certaine résistance à la pression) et sensible, qui contraste avec le reste du foie. La radiographie simple ou avec des produits de contraste et la scintigraphie montreront des images très suggestives.
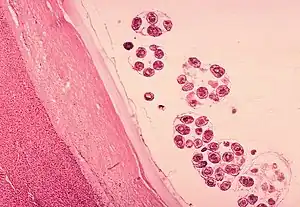
L'évolution se fait à long terme : en général vers la surinfection à partir des voies biliaires septiques, et la rupture dramatique aux voies biliaires, à la veine cave ou en péritoine libre ; quelques rares fois vers la calcification et la guérison spontanée.
Kyste hydatique du poumon. La période de "kyste sain" est courte (moins d'un an), le développement étant rapide et la rencontre avec une bronche précoce. Un contrôle radioscopique à ce stade montre l'image dense, s'ovalisant avec la toux, traditionnelle en "boulet de canon", mais en fait à contour légèrement polygonal.
La période de "kyste malade non rompu" se marque par des crises d'urticaire, une toux, le plus souvent tenace, un fébricule et parfois de petites hémoptysies. D'autres fois, elle passe inaperçue. À la radiographie, le kyste apparaît cerné d'un croissant clair supérieur.
La rupture est bien souvent l'accident inaugural. Elle se fait dans la bronche de drainage, entraînant, dans un tableau de choc souvent impressionnant, la classique vomique (expectoration subite et abondante de sérosité, de pus ou de sang), franche ou fractionnée, contenant granulations et "peaux de raisin", et dans laquelle le laboratoire pourra retrouver les crochets caractéristiques. Exceptionnellement, elle peut se faire à la plèvre. Les images radiographiques sont caractéristiques : pneumokyste avec niveau liquide et membrane flottante (signe du nénuphar) ou hydatido-pneumothorax.
Sans cure chirurgicale, les complications sont à court terme la rétention de membrane et la surinfection, et à long terme, l'atélectasie et la fibrosclérose.
Diagnostic
Sauf dans le cas de la vomique où l'on retrouve le sable hydatique, le diagnostic n'est jamais parasitologique.
La ponction reste toujours formellement contre-indiquée.
La sérologie est maintenant d'un bon secours, immunoélectrophorèse et immunofluorescence apportant la confirmation indirecte.
De nouveaux moyens de détection apparaissent[11] et pourraient se développer (puce à ADN...)
Traitement (1980)
Lorsque l'organisme n'a pas spontanément éliminé lui-même le parasite, seul l'Albendazole (Zentel*) montre une certaine action sur les hydatides et permet d'envisager, à la dose massive de 2 g par jour poursuivie pendant des mois, un traitement médical, au moins dans les formes jeunes et non compliquées.
Dans les autres cas (tardifs) le traitement repose sur une chirurgie d'exérèse parfaitement codifiée.
Prévention
.tif.jpg.webp)
La meilleure prévention est une gestion appropriée des carcasses et viscères des animaux d'élevage pour éviter leur consommation par les chiens. Toutefois, une gestion appropriée des carcasses et des viscères après abattage familial des moutons est difficile dans les communautés pauvres et éloignées des abattoirs organisés. De ce fait, les chiens ont facilement accès aux abats qui contiennent des kystes hydatiques ; ils complètent le cycle parasitaire d’Echinococcus granulosus et sont à l’origine des cas d’échinococcose kystique. L’ébullition pendant 30 minutes des foies et poumons qui contiennent des kystes hydatiques a été proposée comme une méthode simple, efficace et peu coûteuse en temps et en énergie, pour détruire les larves responsables de la contamination[12].
Voir aussi
Articles connexes
- Épidémiologie
- Écoépidémiologie
- Echinococcus multilocularis (Hémisphère nord)
- Echinococcus vogeli (Amérique centrale et du Sud).
- Echinococcus oligarthrus (Amérique centrale et du Sud).
- Parasitisme
- Parasitose
- Interactions durables
Bibliographie
- Vuitton DA, Millon L, Gottstein B, Giraudoux P, « Proceedings of the international symposium — innovation for the management of echinococcosis. Besançon, March 27–29, 2014 », Parasite, vol. 21, , p. 28 (DOI 10.1051/parasite/2014024, lire en ligne)
- Dominique A. Vuitton, Donald P. McManus, Michael T. Rogan, Thomas Romig, Bruno Gottstein, Ariel Naidich, Tuerhongjiang Tuxun, Hao Wen, Antonio Menezes da Silva, Dominique A. Vuitton, Donald P. McManus, Thomas Romig, Michael R. Rogan, Bruno Gottstein, Antonio Menezes da Silva, Hao Wen, Ariel Naidich, Tuerhongjiang Tuxun, Amza Avcioglu, Belgees Boufana, Christine Budke, Adriano Casulli, Esin Güven, Andreas Hillenbrand, Fateme Jalousian, Mohamed Habib Jemli, Jenny Knapp, Abdelkarim Laatamna, Samia Lahmar, Ariel Naidich, Michael T. Rogan, Seyed Mahmoud Sadjjadi, Julian Schmidberger, Manel Amri, Anne-Pauline Bellanger, Sara Benazzouz, Klaus Brehm, Andreas Hillenbrand, Fateme Jalousian, Malika Kachani, Moussa Labsi, Giovanna Masala, Antonio Menezes da Silva, Mahmoud Sadjjadi Seyed, Imene Soufli, Chafia Touil-Boukoffa, Junhua Wang, Eberhard Zeyhle, Tuerganaili Aji, Okan Akhan, Solange Bresson-Hadni, Chadli Dziri, Tilmann Gräter, Beate Grüner, Assia Haïf, Andreas Hillenbrand, Stéphane Koch, Michael T. Rogan, Francesca Tamarozzi, Tuerhongjiang Tuxun, Patrick Giraudoux, Paul Torgerson, Katherina Vizcaychipi, Ning Xiao, Nazmiye Altintas, Renyong Lin, Laurence Millon, Wenbao Zhang, Karima Achour, Haining Fan, Thomas Junghanss et Georges A. Mantion, « International consensus on terminology to be used in the field of echinococcoses », Parasite, vol. 27, , p. 41 (ISSN 1776-1042, PMID 32500855, DOI 10.1051/parasite/2020024, lire en ligne
 )
)
Liens externes
Notes et références
- McManus DP, Thompson RC. Molecular epidemiology of cystic echinococcosis ; Parasitology. 2003; 127 Suppl:S37-51 (résumé).
- David J. Jenkins, Echinococcus, Infection and Immunity ; The Australian Hydatid Control and Epidemiology Program, Canberra, Australia; in Encyclopedia of Immunology (Second Edition) Pages 783–786en ligne : 2004-10-18 (Résumé)
- Rosenzvit MC, Zhang LH, Kamenetzky L, Canova SG, Guarnera EA, McManus DP. Genetic variation and epidemiology of Echinococcus granulosus in ArgentinaParasitology. 1999 May; 118 ( Pt 5):523-30 (résumé)
- A. Varcasia et al., Cystic Echinococcosis in Sardinia: farmers’ knowledge and dog infection in sheep farms ; Veterinary Parasitology ; Doi:10.1016/j.vetpar.2011.05.006 (Résumé, en anglais)
- Eckert J., Epidemiology of Echinococcus multilocularis and E. granulosus in central Europe ; Parassitologia. 1997 Dec; 39(4):337-44 (résumé).
- (en) G. Umhang, C. Richomme, J.-M. Boucher et V. Hormaz, « Prevalence survey and first molecular characterization of Echinococcus granulosus in France », Parasitology Research, vol. 112, no 4, , p. 1809–1812 (ISSN 0932-0113 et 1432-1955, DOI 10.1007/s00436-012-3245-7, lire en ligne, consulté le ).
- (en) J. Bowles et D.P. Mcmanus, « NADH dehydrogenase 1 gene sequences compared for species and strains of the genus Echinococcus », International Journal for Parasitology, vol. 23, no 7, , p. 969–972 (ISSN 0020-7519, DOI 10.1016/0020-7519(93)90065-7, lire en ligne, consulté le ).
- (en) J BOWLES, D BLAIR et D MCMANUS, « Genetic variants within the genus Echinococcus identified by mitochondrial DNA sequencing », Molecular and Biochemical Parasitology, vol. 54, no 2, , p. 165–173 (ISSN 0166-6851, DOI 10.1016/0166-6851(92)90109-w, lire en ligne, consulté le ).
- (en) Gérald Umhang, Céline Richomme, Vanessa Bastid et Jean-Marc Boucher, « National survey and molecular diagnosis of Echinococcus granulosus sensu lato in livestock in France, 2012 », Parasitology, vol. 147, no 6, , p. 667–672 (ISSN 0031-1820 et 1469-8161, DOI 10.1017/s0031182020000190, lire en ligne, consulté le ).
- Bowles J, Blair D, McManus DP., Molecular genetic characterization of the cervid strain ('northern form') of Echinococcus granulosus. Parasitology. 1994 Aug; 109 ( Pt 2):215-21 (résumé)
- Schneider R, Gollackner B, Edel B, Schmid K, Wrba F, Tucek G, Walochnik J, Auer H., Development of a new PCR protocol for the detection of species and genotypes (strains) of Echinococcus in formalin-fixed, paraffin-embedded tissues. Int J Parasitol. 2008 Jul; 38(8-9):1065-71. Epub 2007 Dec 4.
- Jun Li, Chuanchuan Wu, Hui Wang, Huanyuan Liu, Dominique A. Vuitton, Hao Wen et Wenbao Zhang, « Boiling sheep liver or lung for 30 minutes is necessary and sufficient to kill Echinococcus granulosus protoscoleces in hydatid cysts », Parasite, vol. 21, , p. 64 (ISSN 1776-1042, DOI 10.1051/parasite/2014064, lire en ligne) (en anglais avec résumé français)