Échinococcose
L’échinococcose est une zoonose provoquée par un ver plat, l’échinocoque. En Europe, il s'agit principalement d’Echinococcus multilocularis, mais il existe d'autres échinocoques parasites, dans presque toutes les régions du monde.
| Causes | Echinococcus ou Echinococcus granulosus |
|---|---|
| Symptômes | Douleur abdominale, hépatomégalie, amaigrissement, pyrosis, nausée, vomissement, toux et hémoptysie |
| Traitement | Opération chirurgicale et endoscopie chirurgicale |
|---|---|
| Médicament | Albendazole |
| Spécialité | Infectiologie et helminthologiste (d) |
| CIM-10 | B67 |
|---|---|
| CIM-9 | 122.4, 122 |
| DiseasesDB | 4048 |
| MedlinePlus | 000676 |
| eMedicine |
178648 med/1046 |
| MeSH | D004443 |
| Patient UK | Hydatid-disease-pro |
![]() Mise en garde médicale
Mise en garde médicale
Le parasite
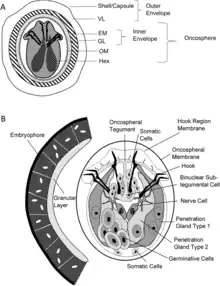
Une échinococcose peut être cystique ou hydatique (causée par Echinococcus granulosus), alvéolaire (E. multilocularis), ou polycystique (E. vogeli ou E. oligarthrus). Ces deux derniers Echinococcus sont plus rares et sont retrouvés essentiellement en Amérique du Sud et en Amérique centrale[1]. Il existe deux autres espèces, E. shiquicus et E. felidis, sans rôle défini dans l'atteinte humaine.
L'échinocoque est avalé par l'hôte. Les animaux concernés sont essentiellement des canidés (chiens pour E. granulosus, renards pour E. multilocularis) où la larve se transforme en adulte dans le tube digestif de l'hôte, permettant la reproduction et le relargage d'œufs par le tube digestif. L'être humain constitue le plus souvent un « hôte en impasse » ne permettant pas la reproduction du parasite. Ce dernier traverse la paroi du tube digestif avant de s'implanter dans différents organes.
L'échinococcose cystique ou « kyste hydatique » est présente dans le pourtour méditerranéen ou en zone tropicale et échinococcose alvéolaire aussi appelée « ténia du renard » est une maladie de l’hémisphère nord[2] - [3]. Il s'agit de parasites différents mais apparentés[2].
Contamination humaine

L'humain se contamine accidentellement par contact direct (exemple : léchage par les chiens et chats, ou en les laissant manger dans nos assiettes, leur salive étant facilement souillée d'œufs) ou indirect (avec chien ou chat principalement, et éventuellement un renard ou autres canidés chassant des rongeurs) aboutissant à l'ingestion d'œufs (microscopiques) du parasite. La contamination la plus fréquente est le contact direct avec les animaux domestiques, celle avec les animaux sauvages étant principalement due à la consommation de fruits sauvages ramassés au sol ou à faible hauteur (fraises des bois, myrtilles, framboises, mûres) et qui ont été contaminés, non par l'urine, mais par des excréments de ces carnivores[4].
Selon les données épidémiologiques disponibles pour l'échinococcose alvéolaire[5], les facteurs de risque pour l'humain sont (en ordre décroissant) :
- être propriétaire de chiens qui consomment des petits mammifères : OR=18.0 ;
- vivre dans une exploitation agricole : OR=6.4 ;
- être propriétaire de chiens qui rôdent sans surveillance : OR=6.1 ;
- collecter du bois : OR=4.7 ;
- être agriculteur : OR=4.7 ;
- mâcher de l’herbe : OR=4.4 ;
- vivre dans une habitation proche des champs : OR=3.0 ;
- aller en forêt pour des raisons professionnelles : OR=2.8 ;
- faire pousser des légumes (racines et feuilles) : OR=2.5 ;
- être propriétaire de chats qui rôdent sans surveillance : OR=2.3 ;
- consommer des baies non lavées : OR=2.2.
Les modes de transmission d’Echinococcus multilocularis restent mal connus dans leur détail : les œufs du ténia sont dispersés dans l'environnement via les crottes de carnivores contaminés (et pas l'urine) : renards, chiens et chats (bien que ces derniers ne soient pas des hôtes optimaux pour le parasite). Manger des fruits des bois crus, des pissenlits, ou tout autre végétal poussant à ras du sol doit donc être évité car ces aliments sont susceptibles d'avoir été souillés par les excréments. Tel n'est pas le cas des produits végétaux poussant à plus de 30 cm de hauteur. La contamination par voie sanguine semble être une autre voie de contamination, par exemple si un chasseur dépeçant une proie contaminée comporte lui-même une coupure qui entre en contact avec les parasites contenus dans le sang de l'animal[6].
Les cas de contamination groupée semblent rares, mais un cas documenté au moins a été signalé[7].
La plupart des personnes sont probablement résistantes au parasite et dans ces cas l'ingestion n'entraîne pas de contamination[3].
Pathogénèse
.PNG.webp)
Chez l'humain, les œufs ingérés se transforment en larves qui vont coloniser le foie et former une pseudo-tumeur au bout de plusieurs années. Les larves peuvent exceptionnellement également atteindre d'autres organes comme les poumons ou le cerveau.
Signes cliniques et diagnostic

L'échinococcose alvéolaire est une maladie grave qui se développe lentement, essentiellement au niveau du foie, sur plus de 15 ans, et de manière asymptomatique. Se traduisant par une hépatomégalie, des douleurs abdominales, un ictère et une fièvre, elle était autrefois souvent confondue avec la cirrhose ou le cancer du foie. La symptomatologie est atypique chez 1/3 environ des patients, avec douleurs abdominales isolées chez 1/3 environ des patients, le dernier tiers présentant une association de symptômes : douleurs abdominales (90 % des cas), hépatomégalie (61 %), altération modérée de l’état général (48 %), ictère, subictère ou prurit (41 %). Il existe une corrélation entre les symptômes et la localisation des lésions[8]. La forme cystique concerne essentiellement le foie et le poumon. La croissance des parasites est longue, sur plusieurs années et le patient est très souvent asymptomatique au début de l'atteinte (ne se plaint d'aucun signe). Les signes apparaissent soit en raison d'une compression d'un organe, soit en raison d'une complication, rupture ou infection. La rupture, tout comme une exérèse mal conduite, peut se compliquer d'une dissémination des kystes à d'autres endroits de l'organisme.
Un diagnostic peut être effectué par la détection des anticorps spécifiques au parasite dans le sang du patient (test remboursé par l’Institut national d'assurance maladie invalidité belge)[9], et en cas de résultat positif être confirmé par imagerie médicale[10].
Mortalité

La mortalité de la forme cystique est comprise entre 2 et 4 %[1]. Celle de la forme alvéolaire est beaucoup plus importante si elle n'est pas traitée correctement, avec une diminution de l'espérance de vie pouvant atteindre 20 ans[11]. Sans traitement, la forme alvéolaire a un risque de décès de 60 % à cinq ans[6].
Traitement
Pour l'échinococcose kystique, les kystes intacts peuvent, dans certains cas, être retirés chirurgicalement : ceci est considéré comme le traitement optimal pour ce genre d'affection. L'ablation chirurgicale des kystes peut être précédée et suivie d'une chimiothérapie. Chez nombre de patients, les composés à base de benzimidazole, comme l'albendazole (vermicide), permettent d'éliminer les kystes ; cependant, certaines souches sont résistantes à ces composés mais peuvent voir le praziquantel et les avermectines produire quelques effets. Chez certains patients présentant des kystes non opérables, il est possible d'employer un traitement comportant une aspiration percutanée, une injection et une réaspiration[12].
Des transplantation de foie sont parfois réalisées dans le traitement de la forme alvéolaire[13].
Prévention et inactivation
La prévention passe notamment par le fait de connaître l'existence et les modes de contamination par le parasite afin de les éviter, le fait d'éviter d'entrer en contact avec les renards (souvent porteurs du parasite), se laver les mains si l'on a eu un contact avec un animal et après avoir touché des végétaux qui pourraient être infestés (lors du jardinage ou d'une randonnée, par exemple), la cuisson à plus de 60 °C et plus de trente minutes de tout aliment provenant de zones pouvant être infestées par le parasite, ne pas manger de baies cueillies à une hauteur de moins de 50 cm du sol et sans les avoir bien lavées[6].
Les œufs (infectants) du parasite sont insensibles à la congélation à −20 °C, mais ils sont tués par la congélation à −80 °C ou par la chaleur (cuisson).
Par ailleurs, ils ont besoin d'un minimum d'humidité pour survivre[14]. Le séchage à l'air ou au four est donc une bonne solution pour tuer les œufs. Un lavage soigneux des plantes ou fruits issus de la cueillette est recommandé, mais peu efficace.
Concernant l'inactivation des œufs par la cuisson, l'Agence Française de Sécurité Sanitaire des Aliments (AFSSA) de Nancy, en 2004 dans un bulletin épidémiologique sur l’échinococcose[15] indiquait, les températures et des durées suivantes : 10 minutes à 60 °C, 5 minutes à 70 °C, une minute à 100 °C. (Pour rappel, Nancy est située à une altitude de 212 mètres, ces valeurs peuvent varier selon votre situation, notamment dans les Hautes-Alpes et Hautes-Pyrénées.)
Zones à risque
Echinococcus granulosus est présent dans le monde entier. Echinococcus multilocularis n'est présent que dans l'hémisphère Nord[16] - [17].
Échinococcose alvéolaire

Dans les années 1980 en Europe, les zones touchées étaient presque toutes des zones de moyenne montagne, avec couverture de neige plusieurs mois par an, dont certaines étaient très favorables à la pullulation de rongeurs prairiaux (campagnol des champs et campagnol terrestre). En France, les études de terrain et cartes de cas[18] - [19](sachant qu'une personne peut déclarer la maladie dans une région, mais l'avoir acquise dans une autre) montrent que la prévalence est plus élevée en Franche-Comté, Lorraine, Alpes, Massif central, et Ardennes. On rapporte cependant quelques cas hors de ces régions.
Depuis les années 1990, le parasite a étendu son aire de distribution traditionnelle (essentiellement le Massif Central, l'Est de la France et la partie nord de l'Arc alpin) vers le nord, l'est, et l'ouest, couvrant maintenant l'ouest et le nord de la France[20], le sud de la Belgique et de la Hollande, l'Allemagne, le Danemark, le sud de la Suède, la Pologne, et la Slovaquie.
En Belgique, la Wallonie semble particulièrement atteinte, avec 40 à 60% des renards porteurs du parasite[21], alors que en région Flamande, seulement 2 à 3% des renards se sont révélés positifs lors d'une récente étude[22].
On estime actuellement qu'il y a environ 15 nouveaux cas détectés par an en France[23].
Au Japon, les campagnols prairiaux n’existent pas ; c'est un rongeur forestier (Clethrionomys rufocanus) qui est l’hôte intermédiaire principal de l'échinocoque. Ailleurs dans le monde, ce sont toujours des rongeurs (campagnols le plus souvent) et des petits lagomorphes comme les pikas, qui semblent être les réservoirs du parasite, tandis que le chien et peut-être le chat (réputé pour être physiologiquement un plus mauvais hôte) restent, avec le renard et d'autres canidés, les maillons de transmission à l'humain.
Constatant la présence importante de renards, chiens, chats dans certaines villes, on s'est intéressé aux cycles urbains de la faune vectrice d’E. multilocularis (renard en particulier)[24] - [25].
Épidémiologie
La maladie atteindrait 2 à 3 millions de personnes dans le monde, la plupart étant de type cystique[1]. Le coût annuel de la maladie est proche de 200 millions de dollars[26].
Échinococcose alvéolaire
En France, au début des années 1980, un observatoire de l'échinococcose alvéolaire[8] a été mis en place, basé sur l'enregistrement des cas humains d'échinococcose alvéolaire, dans un registre (Registre FrancEchino, créé en 1997, en même temps que le réseau européen de surveillance Eurechinoreg, avec étude rétrospective pour la période précédant 1997)[8]. Ce registre a notamment mis en évidence un ratio hommes/femmes d'environ 1 (0,96 ; stable), ainsi qu'un âge médian au diagnostic de 59 ans (stable) avec comme âges extrêmes : 12 et 89 ans, avec très peu de cas déclarés avant 20-30 ans, pour 339 cas diagnostiqués ou suspectés de 1982 à 2005, dont 222 certains avec une moyenne relativement stable de 14 cas incidents/an[8].
En Belgique, un groupe multidisciplinaire d'évaluation et de traitement de l'échinococose alvéolaire[9] (ECHINO-Liege) a été mis en place à l'Université de Liège et au CHU de Liège, université placée au centre de la région la plus atteinte du pays[27].
Le diagnostic semble se faire plus précocement, ce qui pourrait expliquer que, statistiquement, le nombre de formes strictement hépatiques a tendance à augmenter et le nombre des formes métastatiques à diminuer[8]. Sur une plus longue période (du au ), 417 cas ont été recensés par FrancEchino, soit 8 à 29 cas par an, selon les années. L’incidence annuelle moyenne est de 0,26 cas par million d'habitants (de 0,16 à 0,56 selon les années). Sur ce pas de temps, le ratio homme/femme est de 1,00 et l’âge médian au diagnostic est de 60 ans (de 12 à 89). Au moment du diagnostic, 73 % des patients étaient symptomatiques (douleurs abdominales + signes de cholestase en général), avec atteinte primitive hépatique dans 97 % des cas, et métastases extrahépatiques dans 8 % des cas.
Il existe, à échelle régionale, de fortes variations locales de prévalences et de charge parasitaire, selon l’altitude, l'écologie du paysage et, au sein des paysages, selon le « grain écopaysager » qui caractérise la structure et l’hétérogénéité écopaysagère, variations confirmées dans d’autres régions du monde (dont les cantons de Zhang et Puma, Gansu, Chine) où une prévalence de la maladie de plus de 4 % existe localement chez l’humain. En France, où, comme ailleurs, la maladie est distribuée en agrégats géographiques emboîtés[28], cinq départements (Doubs, Haute-Saône, Jura, Vosges, Haute-Savoie), bien que plutôt peu peuplés, ont déclaré 60 % des cas recensés sur cette période, avec pour ces départements une incidence moyenne annuelle supérieure à deux cas par million d'habitants de 1982 à 2009[29].
Le risque de circulation du parasite dans l'environnement est lié à :
- la probabilité pour le renard (ou le chien) de consommer un hôte intermédiaire infecté ;
- la survie des œufs d’échinocoques qui varie selon les conditions de température et d'humidité de l'endroit où ils sont déposés[14] ;
- la probabilité pour un hôte intermédiaire d'ingérer des œufs du parasite, contenus dans les fæces de renard (ou de chien), et lavés par la pluie ou enfouis mécaniquement dans le sol[30] - [31].
Les œufs d’échinocoques ne sont pas mobiles dans l’environnement. Les rongeurs prairiaux ne se déplacent que sur des distances inférieures à quelques centaines de mètres au plus, et généralement moins de quelques dizaines de mètres[32] - [33]. Chiens, chats et renards pour se contaminer doivent donc venir manger un petit mammifère contaminé. Le comportement du renard est lui-même modifié par la fréquentation humaine, des chiens et/ou par la chasse qu’on lui donne, ainsi que par diverses modifications anthropiques du paysage, ce qui peut modifier la répartition et localisation de ses fèces dans l’environnement[25]. Les caractéristiques paysagères peuvent modifier la dynamique des populations des hôtes de l'échinocoque alvéolaire et donc l'intensité de la transmission[34] - [35].
Notes et références
- McManus DP, Gray DJ, Zhang W, Yang Y, Diagnosis, treatment, and management of echinococcosis, BMJ, 2012;344:e3866
- « SanteRomande.ch - Échinococcose », sur www.santeromande.ch (consulté le )
- RTS.ch, « CQFD du 05.03.2019 - Le point sur lʹéchinococcose alvéolaire », sur rts.ch, (consulté le )
- Laurence Ottenheimer, La montagne, Fleurus, , p. 39.
- (en) Kern P. et al. « Risk Factors for Alveolar Echinoccocosis in Humans » Emerg Infect Dis. 2004;10(12):2088-93.
- Netgen, « Randonnée : conseils utiles aux patients (2e partie) - Revue Médicale Suisse », sur Revue Médicale Suisse (consulté le )
- Unique family clustering of human echinococcosis cases in a chinese community. Am J Trop Med Hyg 2006 74:487-494 (Résumé)
- observatoire de l'échinococcose alvéolaire
- A. Cambier, J. B. Giot, P. Leonard et N. Bletard, « [Multidisciplinary management of alveolar echinococcosis : Echino-Liege Working Group] », Revue Medicale De Liege, vol. 73, no 3, , p. 135–142 (ISSN 0370-629X, PMID 29595013, lire en ligne, consulté le )
- [www.lasante.net/maladies/fromanimal/echinococcose.htm L'échinococcose alvéolaire humaine] LaSante.net - Janvier 2003
- Paul R. Torgerson, Alexander Schweiger, Peter Deplazes, Maja Pohar, Jürg Reichen, Rudolf W. Ammann, Philip E. Tarr, Nerman Halkik et Beat Müllhaupt, « Alveolar echinococcosis: From a deadly disease to a well-controlled infection. Relative survival and economic analysis in Switzerland over the last 35 years », Journal of Hepatology, vol. 49, no 1, , p. 72–77 (ISSN 0168-8278, DOI 10.1016/j.jhep.2008.03.023)
- Gouvernement du Canada, Agence de la santé publique du Canada, « Echinococcus granulosus - Fiche technique santé-sécurité : agents pathogènes », sur www.phac-aspc.gc.ca (consulté le )
- « Médecine - Trente ans de transplantation hépatique à Besançon, zoom arrière avec le professeur Mantion, l’un des pionniers - L’épopée de la greffe du foie au CHRU de Besançon », sur www.estrepublicain.fr, (consulté en )
- Veit, P., Bilger, B., Schad, V., Schäfer, Frank, W. and Lucius, R. (1995). Influence of environmental factors on the infectivity of Echinococcus multilocularis eggs. Parasitology, 110, 79-86.
- http://agriculture.gouv.fr/sites/minagri/files/documents/be_15.pdf
- Alessandro Massolo, Stefano Liccioli, Christine Budke et Claudia Klein, « Echinococcus multilocularis in North America: the great unknown », Parasite, vol. 21, , p. 73 (ISSN 1776-1042, PMID 25531581, PMCID 4273702, DOI 10.1051/parasite/2014069, lire en ligne)
- J. Eckert et P. Deplazes, « Biological, Epidemiological, and Clinical Aspects of Echinococcosis, a Zoonosis of Increasing Concern », Clinical Microbiology Reviews, vol. 17, no 1, , p. 107–135 (ISSN 0893-8512, DOI 10.1128/CMR.17.1.107-135.2004)
- Carte des cas humains de 1982 à 2001, en France, publiée parle réseau SAGIR/ONCFS, lettre no 149, p. 5 sur 12
- Site de référence européen (en 3 langues), avec nombreuses cartes
- Benoît Combes, Sébastien Comte, Vincent Raton, Francis Raoul, Franck Boué, Gérald Umhang, Stéphanie Favier, Charlotte Dunoyer, Natacha Woronoff et Patrick Giraudoux, « Westward Spread of Echinococcus multilocularis in Foxes, France, 2005–2010 », Emerging Infectious Diseases, vol. 18, no 12, , p. 2059–2062 (ISSN 1080-6040, DOI 10.3201/eid1812.120219)
- (en) B. Losson, T. Kervyn, J. Detry et P.-P. Pastoret, « Prevalence of Echinococcus multilocularis in the red fox (Vulpes vulpes) in southern Belgium », Veterinary Parasitology, vol. 117, nos 1-2, , p. 23–28 (DOI 10.1016/j.vetpar.2003.08.003, lire en ligne, consulté le )
- (en) F. Jansen, M. Claes, E. Bakkers et A. Aryal, « Echinococcus multilocularis in red foxes in North Belgium: Prevalence and trends in distribution », Veterinary Parasitology: Regional Studies and Reports, vol. 22, , p. 100470 (DOI 10.1016/j.vprsr.2020.100470, lire en ligne, consulté le )
- Frédéric Grenouillet et al, « L’échinococcose alvéolaire humaine en France en 2010 », Bulletin épidémiologique hebdomadaire, , p. 24 (lire en ligne).
- (en) Deplazes, P., D. Hegglin, S. Gloor and T. Romig, « Wilderness in the city: the urbanization of Echinococcus multilocularis » Trends in Parasitology 2004;20:77-84.
- Stefano Liccioli, Patrick Giraudoux, Peter Deplazes et Alessandro Massolo, « Wilderness in the ‘city’ revisited: different urbes shape transmission of Echinococcus multilocularis by altering predator and prey communities », Trends in Parasitology, vol. 31, no 7, , p. 297–305 (ISSN 1471-4922, DOI 10.1016/j.pt.2015.04.007)
- (en) Budke CM, Deplazes P, Torgerson PR, « Global socioeconomic impact of cystic echinococcosis » Emerg Infect Dis. 2006;12:296-303
- (en) Audrey Cambier, Philippe Leonard, Bertrand Losson et Jean-Baptiste Giot, « Alveolar echinococcosis in southern Belgium: retrospective experience of a tertiary center », European Journal of Clinical Microbiology & Infectious Diseases, vol. 37, no 6, , p. 1195–1196 (ISSN 0934-9723 et 1435-4373, DOI 10.1007/s10096-018-3233-7, lire en ligne, consulté le )
- Zeinaba Said-Ali, Frédéric Grenouillet, Jenny Knapp, Solange Bresson-Hadni, Dominique Angèle Vuitton, Francis Raoul, Carine Richou, Laurence Millon et Patrick Giraudoux, « Detecting nested clusters of human alveolar echinococcosis », Parasitology, vol. 140, no 13, , p. 1693–1700 (ISSN 0031-1820, DOI 10.1017/S0031182013001352)
- Encadré. L’échinococcose alvéolaire humaine en France en 2010 Box. Human alveolar echinococcosis in France, update 2010
- Delattre, P., Pascal, M., Le Pesteur, M. H., Giraudoux, P. and Damange, J. P. (1988). Caractéristiques écologiques et épidémiologiques de l'Echinococcus multilocularis au cours d'un cycle complet des populations d'un hôte intermédiaire (Microtus arvalis). Canadian Journal of Zoology, 66(12), 2740-2750.
- Delattre, P., Giraudoux, P. and Quere, J. P. (1990). Conséquences épidémiologiques de la réceptivité d'un nouvel hôte intermédiaire du Ténia multiloculaire (Echinococcus multilocularis) et de la localisation spatiotemporelle des rongeurs infestés. Comptes rendus de l'Académie des Sciences, Paris, III, 310(III), 339-344.
- Spitz, F. (1977) « Le campagnol des champs (Microtus arvalis (Pallas)) en Europe » Bull. OEPP 1977;7:165-75.
- Airoldi, J.P. « Étude par capture et recapture d’une population de Campagnols terrestres Arvicola terrestris » scherman Shaw. Rev. Ecol. (Terre Vie) 1978;32:3-45.
- P. Giraudoux, P. S. Craig, P. Delattre, G. Bao, B. Bartholomot, S. Harraga, J.-P. Qur, F. Raoul, Y. Wang, D. Shi et D.-A. Vuitton, « Interactions between landscape changes and host communities can regulate Echinococcus multilocularis transmission », Parasitology, vol. 127, no 7, , S119–S129 (ISSN 0031-1820, DOI 10.1017/S0031182003003512)
- Patrick Giraudoux, Francis Raoul, David Pleydell, Tiaoying Li, Xiuming Han, Jiamin Qiu, Yan Xie, Hu Wang, Akira Ito et Philip S. Craig, « Drivers of Echinococcus multilocularis Transmission in China: Small Mammal Diversity, Landscape or Climate? », PLoS Neglected Tropical Diseases, vol. 7, no 3, , e2045 (ISSN 1935-2735, DOI 10.1371/journal.pntd.0002045)
Voir aussi
Bibliographie
- Dominique A. Vuitton, Donald P. McManus, Michael T. Rogan, Thomas Romig, Bruno Gottstein, Ariel Naidich, Tuerhongjiang Tuxun, Hao Wen, Antonio Menezes da Silva, Dominique A. Vuitton, Donald P. McManus, Thomas Romig, Michael R. Rogan, Bruno Gottstein, Antonio Menezes da Silva, Hao Wen, Ariel Naidich, Tuerhongjiang Tuxun, Amza Avcioglu, Belgees Boufana, Christine Budke, Adriano Casulli, Esin Güven, Andreas Hillenbrand, Fateme Jalousian, Mohamed Habib Jemli, Jenny Knapp, Abdelkarim Laatamna, Samia Lahmar, Ariel Naidich, Michael T. Rogan, Seyed Mahmoud Sadjjadi, Julian Schmidberger, Manel Amri, Anne-Pauline Bellanger, Sara Benazzouz, Klaus Brehm, Andreas Hillenbrand, Fateme Jalousian, Malika Kachani, Moussa Labsi, Giovanna Masala, Antonio Menezes da Silva, Mahmoud Sadjjadi Seyed, Imene Soufli, Chafia Touil-Boukoffa, Junhua Wang, Eberhard Zeyhle, Tuerganaili Aji, Okan Akhan, Solange Bresson-Hadni, Chadli Dziri, Tilmann Gräter, Beate Grüner, Assia Haïf, Andreas Hillenbrand, Stéphane Koch, Michael T. Rogan, Francesca Tamarozzi, Tuerhongjiang Tuxun, Patrick Giraudoux, Paul Torgerson, Katherina Vizcaychipi, Ning Xiao, Nazmiye Altintas, Renyong Lin, Laurence Millon, Wenbao Zhang, Karima Achour, Haining Fan, Thomas Junghanss et Georges A. Mantion, « International consensus on terminology to be used in the field of echinococcoses », Parasite, vol. 27, , p. 41 (ISSN 1776-1042, PMID 32500855, DOI 10.1051/parasite/2020024, lire en ligne
 )
) - Vuitton DA, Millon L, Gottstein B, Giraudoux P, « Proceedings of the international symposium — innovation for the management of echinococcosis. Besançon, March 27–29, 2014 », Parasite, vol. 21, , p. 28 (DOI 10.1051/parasite/2014024, lire en ligne
 )
) - Dominique Angèle Vuitton, Solange Bresson-Hadni, Patrick Giraudoux, Brigitte Bartholomot, Jean-Jacques Laplante, Eric Delabrousse, Oleg Blagosklonov et Georges Mantion, « Échinococcose alvéolaire : d’une maladie rurale incurable à une infection urbaine sous contrôle ? », La Presse Médicale, vol. 39, no 2, , p. 216–230 (ISSN 0755-4982, DOI 10.1016/j.lpm.2008.10.028)
- Piarroux M, Gaudart J, Bresson-Hadni S, Bardonnet K, Faucher B, Grenouillet F, Knapp J, Dumortier J, Watelet J, Gerard A, Beytout J, Abergel A, Wallon M, Vuitton DA, Piarroux R; FrancEchino network. Landscape and climatic characteristics associated with human alveolar echinococcosis in France, 1982 to 2007. Euro Surveill. 2015 May 7;20(18). pii: 21118. () [lire en ligne]
- Piarroux M, Piarroux R, Knapp J, Bardonnet K, Dumortier J, Watelet J, Gerard A, Beytout J, Abergel A, Bresson-Hadni S, Gaudart J; FrancEchino Surveillance Network. Populations at risk for alveolar echinococcosis, France. Emerg Infect Dis. 2013 May;19(5):721-8. (doi: 10.3201/eid1905.120867)
Articles connexes
- Épidémiologie
- Écoépidémiologie
- Echinococcus granulosus (qui semble présent dans le monde entier)
- Echinococcus multilocularis (Hémisphère nord)
- Echinococcus vogeli (Amérique centrale et du Sud).
- Echinococcus oligarthrus (Amérique centrale et du Sud).
- Parasitisme
- Fasciolose
- Interactions durables
- Jacques Euzéby (parasitologue)
- Félix Dévé
Liens externes
- Échinococcose, Descripteur MeSH, CHU de Rouen (France).
- Échinococcose alvéolaire, fiche ministère agriculture français.
- Recommandations vis-à-vis de l'échinococcose alvéolaire, AFSSA-Nancy (France).
