Dioxyde d'étain
Le dioxyde d'étain, ou oxyde d'étain(IV), est un composé chimique de formule SnO2. Sa forme minérale est la cassitérite, qui est le principal minerai d'étain.
| Dioxyde d'étain | |
 __ Sn4+ __ O2− Maille cristalline du dioxyde d'étain |
|
| Identification | |
|---|---|
| Nom UICPA | dioxoétain |
| Synonymes |
oxyde d'étain(IV), |
| No CAS | |
| No ECHA | 100.038.311 |
| No CE | 242-159-0 |
| No RTECS | XQ4000000 |
| PubChem | 29011 |
| ChEBI | 52991 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | O2Sn |
| Masse molaire[1] | 150,709 ± 0,008 g/mol O 21,23 %, Sn 78,77 %, |
| Propriétés physiques | |
| T° fusion | 1 630 °C[2] |
| Masse volumique | 6,95 g·cm-3 à 20 °C[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physiques
Le dioxyde d'étain est un solide diamagnétique incolore, semiconducteur et amphotère, prenant l'apparence d'une poudre cristallisée blanche. C'est la forme la plus fréquente de la chimie de l'étain.
Il cristallise avec la maille du rutile, dans laquelle les atomes d'étain ont une coordinence égale à 6 et les atomes d'oxygène ont une coordinence égale à 3. SnO2 est généralement considéré comme un semiconducteur de type n à déficit d'oxygène.
Réactions chimiques
Le dioxyde d'étain est purifié par réduction jusqu'à l'étain puis combustion de celui-ci à l'air libre.
Les oxydes d'étain se dissolvent dans les acides. Les acides halogénohydriques attaquent SnO2 pour donner des hexahalostannates tels que [SnI6]2−. La réaction d'un échantillon attaqué par de l'acide iodhydrique HI pendant plusieurs heures a été décrite[3] :
De la même façon, SnO2 se dissout dans l'acide sulfurique H2SO4 pour donner le sulfate d'étain(IV) Sn(SO4)2 :
SnO2 se dissout dans les bases fortes pour donner des stannates, par exemple avec l'hydroxyde de sodium NaOH pour donner du stannate de sodium Na2SnO3. La dissolution dans l'eau du mélange fondu SnO2/NaOH donne l'espèce chimique Na2[Sn(OH)6]2.
Utilisation
- Mélangé à l'oxyde d'indium(III) (In2O3), il forme l'oxyde d'indium-étain (ITO) qui représente le matériau idéal pour réaliser les fines électrodes transparentes recouvrant les écrans LCD.
 Poudre de SnO2.
Poudre de SnO2.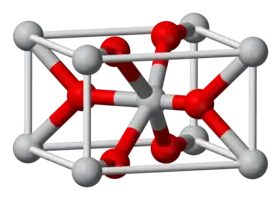 Maille cristalline de type rutile.
Maille cristalline de type rutile.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Tin(IV) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 novembre 2011 (JavaScript nécessaire)
- (en) E. R. Caley, « The action of Hydriodic Acid on Stannic Oxide », J. Am. Chem. Soc., vol. 54, no 8, , p. 3240–3243 (ISSN 0002-7863 et 1520-5126, DOI 10.1021/ja01347a028)
Voir aussi
Articles connexes
Bibliographie
- Sergent N (2003) Dioxyde d'étain : Synthèse, caractérisation et étude des interactions avec différents gaz polluants - Application à la catalyse de NOx ; Catalysis. Université Jean Monnet - Saint-Étienne <tel-00002302v2> PDF, 248 p