Diméthylarginine asymétrique
La diméthylarginine asymétrique (ADMA) est un dérivé doublement méthylé de l'arginine, un acide aminé protéinogène. Produite continuellement au sein du cytoplasme de toutes cellules humaines par les processus de modification des protéines au cours du métabolisme, elle est naturellement présente dans le plasma sanguin. Elle interfère avec l'arginine dans la production du monoxyde d'azote, un composé chimique critique impliqué dans le fonctionnement normal de l'endothélium et, par extension, de l'appareil cardiovasculaire.
| Nω,Nω-Diméthyl-L-arginine | |
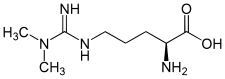
| |
| Structure de la Nω,Nω-diméthyl-L-arginine | |
| Identification | |
|---|---|
| Nom UICPA | N5-(N,N-diméthylcarbamimidoyl)-L-ornithine |
| Synonymes |
diméthylarginine asymétrique |
| No CAS | |
| DrugBank | DB01686 |
| ChEBI | 17929 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H18N4O2 [Isomères] |
| Masse molaire[1] | 202,254 1 ± 0,009 1 g/mol C 47,51 %, H 8,97 %, N 27,7 %, O 15,82 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La diméthylarginine asymétrique est produite par méthylation de protéines, modification post-traductionnelle fréquente, sous l'effet d'une protéine-arginine N-méthyltransférase (EC : PRMT1 (en) et PRMT2 (en))[2]. Les groupes méthyle ainsi transférés proviennent de la S-adénosylméthionine, intermédiaire du métabolisme de l'homocystéine ; cette dernière est d'ailleurs un indicateur important de maladies cardiovasculaires. La diméthylarginine produite migre ensuite dans le milieu extracellulaire puis dans le plasma. Elle est clivée en citrulline et diméthylamine par la diméthylargininase et est éliminée par voie rénale.
La concentration en ADMA est mesurée par chromatographie en phase liquide à haute performance. Elle augmente sensiblement sous l'effet du cholestérol LDL[3].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Nenoo Rawal, Ramesh Rajpurohit, Michael A. Lischwe, Kenneth R. Williams, Woon Ki Paik et Sangduk Kim, « Structural specificity of substrate for S-adenosylmethionine protein arginine N-methyltransferases », Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology, vol. 1248, no 1, , p. 11-18 (PMID 7536038, DOI 10.1016/0167-4838(94)00213-Z, lire en ligne)
- (en) Rainer H. Böger, Karsten Sydow, Jürgen Borlak, Thomas Thum, Henrike Lenzen, Bibiana Schubert, Dimitrios Tsikas et Stefanie M. Bode-Böger, « LDL Cholesterol Upregulates Synthesis of Asymmetrical Dimethylarginine in Human Endothelial Cells. Involvement of S-Adenosylmethionine–Dependent Methyltransferases », Circulation Research, vol. 87, no 2, , p. 99-105 (PMID 10903992, DOI 10.1161/01.RES.87.2.99, lire en ligne)