Citrulline
La citrulline (C6H13N3O3) est un acide aminé non protéinogène. La citrulline a été identifiée pour la première fois il y a plus de 70 ans à partir de la pastèque Citrullus lanatus dont elle tient son nom. La pastèque est la plus importante source de citrulline connue à ce jour (0,7 à 3,6 g·kg-1 de pulpe selon l’espèce et le degré de maturité)[3]. Elle a pu être isolée mais non quantifiée dans d’autres cucurbitacées telles que le concombre, le melon, la citrouille, la courge. Chez la plupart des mammifères, l’intestin grêle est la principale source de citrulline circulante. Elle entre dans la synthèse endogène de l’arginine.
| Citrulline | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide 2-amino-5-(carbamoylamino)pentanoïque | |
| No CAS | ||
| No ECHA | 100.006.145 | |
| No CE | 206-759-6[1] | |
| PubChem | 9750 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
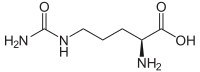
| Formule | C6H13N3O3 [Isomères] |
|
| Masse molaire[2] | 175,185 7 ± 0,007 2 g/mol C 41,14 %, H 7,48 %, N 23,99 %, O 27,4 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés physico-chimiques
La citrulline est un solide incolore et inodore à température et pression ambiantes. Son point de fusion est à 222 °C. C’est un α-amino acide comportant un carbone asymétrique d’où il présente deux énantiomères. Comme la plupart des acides aminés, sa forme naturelle est la forme L.
La citrulline a une masse moléculaire de 175 g/mol. Ses propriétés chimiques résultent de sa fonction acide aminé et également de sa fonction urée en position terminale de la chaine aliphatique qui se substitue au carbone α. Grâce à sa chaine polaire latérale, la citrulline est soluble dans l’eau mais très peu soluble dans le méthanol et l’éthanol. Comme tous les autres acides aminés, la citrulline présente deux acidités des groupes acide carboxylique (pka ≈2,4) amine (pka≈ 9,4)[4].
Métabolisme de la citrulline circulante
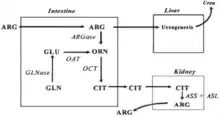
La L-citrulline a longtemps été uniquement considérée comme un simple intermédiaire métabolique du métabolisme protéique. En effet, dans le foie, elle est un intermédiaire du cycle de l'urée, permettant d'épurer l’excès d’azote de l'organisme, et notamment en situation d'hyperammoniémie.
Cependant, le métabolisme de la L-citrulline libre est bien plus complexe et implique trois enzymes clés :
- l’ornithine carbamoyltransférase (OCT) qui produit la L-citrulline ;
- l’arginosuccinate synthétase (ASS) qui la convertit en arginosuccinate ;
- la NO synthétase (NOS) qui produit la L-citrulline et le monoxyde d’azote (·NO) à partir d’arginine.
L’étude de la distribution de ces enzymes et l’utilisation d’isotopes stables d’acides aminés ont permis de mettre en évidence le métabolisme complexe de la L-citrulline où se distinguent trois voies métaboliques.
- La première de ces voies a lieu au niveau du foie : la L-citrulline est synthétisée localement par l’OCT en tant qu’étape de l’uréogenèse, indispensable à l’organisme pour éliminer l’azote excédentaire et l’ammoniac neurotoxique sous forme d’urée.
- La deuxième de ces voies implique l’intestin et les reins : l’intestin est le principal producteur de L-citrulline (via l’OCT ≈ 10 g/j chez l’adulte sain)[5], qui est alors libérée dans la circulation périphérique et à nouveau convertie en arginine dans les reins (par l’ASS)[6] ce qui permet d’assurer la synthèse endogène d’arginine. En effet, l’arginine absorbée par l’intestin est quasi totalement dégradée au niveau hépatique par l’importante activité de l’arginase présente dans le foie[7] - [8]. De plus, l’arginine exerce un rétrocontrôle positif sur l’uréogenèse (à travers une stimulation de la N-acétylglutamate synthase[9]), ce qui pourrait entraîner une dégradation excessive de l’arginine et de tous les acides aminés lors d’apports importants en arginine. La L-citrulline n’étant pas captée par le foie[5], elle constituerait un excellent moyen physiologique de préserver l’arginine pour son utilisation au niveau périphérique.
- La troisième voie métabolique est un recyclage de la L-citrulline en arginine à travers l’ASS présente dans les reins et dans les tissus producteurs de ·NO pour augmenter la disponibilité de l’arginine et pour produire du ·NO. La connaissance du métabolisme de la L-citrulline permet de comprendre ses effets physiologiques et nutritionnels notamment en tant que marqueur de la fonction intestinale ou précurseur d’arginine.
Tolérance
Les données de la littérature montrent que la L-citrulline est généralement considérée totalement tolérée pour la consommation orale chez l’humain[10] - [11] même à des doses importantes (15 g par jour) - [12], contrairement à d’autres acides aminés et particulièrement à l’arginine et l’ornithine, deux acides aminés métaboliquement liés à la L-citrulline. En effet, l’arginine et l’ornithine ont des effets secondaires gastro-intestinaux non négligeables se manifestant généralement par une diarrhée[13]. Cette différence de tolérance entre la L-citrulline et ses acides aminés métaboliquement liés s’expliquerait par une différence au niveau du transport intestinal de ces acides aminés, l’absorption intestinale d’arginine et d’ornithine étant plus facilement saturable que celle de L-citrulline, induisant alors une diarrhée osmotique [13].
Maladies héréditaires liées au métabolisme de la citrulline
Plusieurs pathologies sont associées à un déficit en L-citrulline. En effet, des mutations touchant les enzymes impliquées dans le métabolisme de la L-citrulline se traduisent souvent par un déficit en cet acide aminé, entraînant des perturbations du cycle de l’urée. Elle s’est en effet montrée efficace dans des cas de déficience en OTC ou en carbamyl-phosphate synthase, ou encore dans le traitement du syndrome H (déficience en transport mitochondrial d’ornithine liée au chromosome 13[14] - [15]) et de l’intolérance aux protéines dibasiques[16].
Propriétés nutritionnelles et thérapeutiques
Alternative à la supplémentation en arginine
La mise en évidence du rôle de la L-citrulline en tant que précurseur naturel d’arginine a permis d’envisager l’utilisation de la L-citrulline en tant qu’alternative à l’arginine qui, apportée par l’alimentation, est en partie retenue par l’intestin et massivement dégradée par le foie dans le cadre de l’uréogenèse. En effet, l’administration de L-citrulline chez les volontaires sains est associée à une augmentation des concentrations plasmatiques de L-citrulline et des acides aminés métaboliquement liés (c'est-à-dire arginine et ornithine)[12] - [15] - [17] - [18] - [19]. Or, le rôle de l’arginine dans les processus de cicatrisation, d'activation lymphocytaire, de synthèse d'insuline et d'hormone de croissance lui confère des effets immunomodulateurs importants[20] - [21]. L’arginine est par ailleurs un acide aminé dit « conditionnellement » indispensable dans certaines conditions physiopathologiques (stress catabolique, insuffisance intestinale ou rénale, etc.). Toutefois, l’arginine est largement métabolisée par le foie, ce qui remet en cause l’efficacité d’une complémentation en arginine. Or, la L-citrulline n’est pas captée par le foie et passe librement jusqu’aux reins où elle est métabolisée en arginine. C’est donc une bonne stratégie pour générer de l’arginine et améliorer le statut nutritionnel, comme il a été démontré très récemment chez des personnes âgées[11].
Citrulline pure ou malate de Citrulline
La L-citrulline est généralement disponible sous forme de poudre. Plusieurs fabricants dans le monde fabriquent de la L-Citrulline à partir de fermentation. Les principaux sites de production de situent aux États-Unis, en Chine et au Japon. Le malate de citrulline est une combinaison de citrulline base et de DL malate. Le DL malate ne possédant pas de fonction anabolique[22], sa présence à côté de la citrulline ne présente pas d'intérêt.
Action sur la synthèse protéique
Des données récentes de la littérature montrent que la L-citrulline est largement impliquée dans la régulation de l’homéostasie azotée avec, notamment, une action directe de la L-citrulline sur la synthèse protéique musculaire[23], ceci a fait l'objet de plusieurs brevets déposés par l'université Paris Descartes. La citrulline, échappant à la séquestration splanchnique, représente une stratégie nutritionnelle intéressante pour préserver la masse musculaire lors du vieillissement[11] - [17] - [24] - [25], au cours duquel la séquestration splanchnique, augmentée des acides aminés, induit une diminution de la synthèse protéique musculaire postprandiale. Ainsi, des travaux de recherche chez l’animal et chez l’humain ont été menés pour vérifier que la citrulline augmente la synthèse protéique et la masse musculaires[11] - [12] - [17] - [24] - [25] - [26] - [27] - [28].
Études réalisées chez l'animal
Chez le rat âgé sain, une complémentation en citrulline pendant 3 mois induit une augmentation de la masse maigre de l’ordre de 8 % (et en particulier une augmentation de la masse musculaire de l’ordre de 25 %), associée à une diminution de la masse grasse cutanée (- 14 %) et intra-abdominale (- 42 %) [24], suggérant qu’une complémentation en citrulline permet de corriger les effets du vieillissement sur la composition corporelle. Dans un travail princeps réalisé chez des rats âgés dénutris, un apport oral de citrulline permet d’augmenter de plus de 20 % le contenu protéique musculaire et de plus de 90 % la synthèse protéique musculaire[26]. Sur ce même modèle, une complémentation orale en citrulline permet d’augmenter la force musculaire de 37 %[29].
Études réalisées chez l'humain
Chez l’adulte jeune, la consommation de 2, 5, 10 ou 15 g de citrulline est très bien tolérée et induit une augmentation de l’argininémie et du bilan azoté selon le dosage[12] - [30]. Les auteurs de la pharmacocinétique préconisent la dose de 10 g en utilisation clinique, en tant qu’adjuvant des traitements de la dénutrition et de la sarcopénie par exemple. Des résultats similaires ont été obtenus chez l'adulte âgé[11]. Une étude chez le volontaire sain soumis pendant 3 jours à un régime hypoprotéique montre qu’une complémentation en citrulline induit une augmentation de 25 % de la vitesse de la synthèse protéique musculaire[28]. Pour des raisons méthodologiques, la citrullinémie de ces sujets devait être stable. Elle était comprise entre 800 et 1 000 µM. La pharmacocinétique indique que pour obtenir une telle citrullinémie, une dose de 3,5 g de citrulline doit être ingérée. Chez des personnes âgées dénutries hospitalisées, un essai clinique randomisé en double aveugle montre qu'une complémentation en citrulline de 10 g par jour pendant 21 jours permet d'augmenter de 5 à 10 % la masse musculaire [25]. Dans le même sens, chez des seniors de plus de 60 ans sarcopéniques (et obèses), 10 g de L-citrulline par jour pendant 3 mois, associés à un entrainement physique, est plus efficace pour augmenter la force musculaire et la fonction musculaire que l’entrainement physique sans association avec la citrulline [31]. Et dans une population de seniors plus hétérogènes, il a aussi été démontré que cette association entrainement physique et citrulline était plus bénéfique aux personnes qui consomment moins de 1g/kg/j de protéines que chez celles consommant plus de 1g/kg/j de protéines [32].
Marqueur de la fonction intestinale
Ces dernières années, l’intérêt de la citrulline a fortement augmenté avec la mise en évidence du rôle de la citrulline en tant que marqueur non-invasif de la fonctionnalité intestinale[33] - [34] - [35]. Ce concept a été inventé par Pascal Crenn, médecin et biologiste français, au cours de sa thèse (Université Paris Diderot), soutenue en 2000, sous la direction du Pr Bernard Messing[36]. En effet, des études tant chez l’animal que chez l’humain, ont montré une corrélation entre la citrullinémie et la longueur de l’intestin résiduel après une résection intestinale[33] - [37], ou la masse entérocytaire dans la maladie cœliaque[34], la transplantation intestinale et les lésions résultant de radiations ionisantes[38].
Antioxydante
Dans la pastèque, la citrulline est un antioxydant majeur[39]. Elle lui permet notamment de résister aux périodes de sécheresse. Chez le rat âgé, une étude expérimentale a montré l’effet protecteur de la citrulline sur l’oxydation des VLDL et LDL dont l’oxydation est fortement impliquée dans le développement de l’athérosclérose. L’effet protecteur de la citrulline sur les HDL pourrait protéger leur fonction antiathérogène[40].
Hypoammoniémiantes
La citrulline a longtemps été administrée pour traiter des troubles héréditaires du cycle de l’urée pour son rôle d’agent hypoammoniémiant. Elle s’est en effet montrée efficace dans des cas de déficience en OTC ou en carbamyl-phosphate synthétase, ou encore dans le traitement du syndrome H (déficience en transport mitochondrial liée au chromosome 13[14] - [15] et de l’intolérance aux protéines dibasiques[16]). Ses propriétés hyperammoniémiantes sont également à la base de son utilisation en tant qu’antiasthénique dans le traitement de la fatigue musculaire par le malate de citrulline.
Modulateur du métabolisme du radical oxyde nitrique
La citrulline est un excellent précurseur d’arginine pour la synthèse du radical oxyde nitrique (•NO)[10] - [17] - [41] - [42]. L’administration de citrulline pourrait donc entrer dans une stratégie thérapeutique dans le traitement de perturbations du métabolisme du •NO et l’amélioration de la fonction vasculaire, ce qui inclut l’hypertension, l’insuffisance cardiaque, le diabète et les lésions d’ischémie-reperfusion où l’arginine a déjà fait ses preuves.
Notes et références
- (en) PubChem, « Citrulline », sur pubchem.ncbi.nlm.nih.gov (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Rimando AM, Perkins-Veazie PM. « Determination of citrulline in watermelon rind » J Chromatogr A. 2005;1078(1-2):196-200.
- (en) Curis E, Nicolis I, Moinard C, Osowska S, Zerrouk N, Bénazeth S. et al. « Almost all about citrulline in mammals » Amino Acids 2005;29(3):177-205.
- (en) Windmueller HG, Spaeth AE. « Source and fate of circulating citrulline » Am. J. Physiol. 1981;241(6):E473-480.
- (en) Castillo L, Chapman TE, Sanchez M, Yu YM, Burke JF, Ajami AM. et al. « Plasma arginine and citrulline kinetics in adults given adequate and arginine-free diets » Proc. Natl. Acad. Sci. U.S.A. 1993;90(16):7749-53.
- (en) Gotoh T, Araki M, Mori M. « Chromosomal localization of the human arginase II gene and tissue distribution of its mRNA » Biochem Biophys Res Commun. 1997 avr 17;233(2):487-91.
- (en) Herzfeld A, Raper SM. « The heterogeneity of arginases in rat tissues » Biochem J. 1976;153(2):469-78.
- (en) Meijer AJ, Lamers WH, Chamuleau RA. « Nitrogen metabolism and ornithine cycle function » Physiol. Rev. 1990;70(3):701-48.
- (en) Romero MJ, Platt DH, Caldwell RB, Caldwell RW. « Therapeutic use of citrulline in cardiovascular disease » Cardiovasc Drug Rev. 2006;24(3-4):275-90.
- (en) Moinard C, Maccario J, Walrand S, Lasserre V, Marc J, Boirie Y, Cynober L. « Arginine behaviour after arginine or citrulline administration in older subjects » Br. J. Nutr. 2016;14;115(3):399-404.
- (en) Moinard C, Nicolis I, Neveux N, Darquy S, Bénazeth S, Cynober L. « Dose-ranging effects of citrulline administration on plasma amino acids and hormonal patterns in healthy subjects: the Citrudose pharmacokinetic study » Br J Nutr. 2008;99(4):855-62.
- GK. Grimble « Adverse Gastrointestinal Effects of Arginine and Related Amino Acids » J Nutr. 2007;137(6):1693S-1701S.
- (en) Awrich AE, Stackhouse WJ, Cantrell JE, Patterson JH, Rudman D. « Hyperdibasicaminoaciduria, hyperammonemia, and growth retardation: Treatment with arginine, lysine, and citrulline » J Pediatr. 1975 nov;87(5):731-8.
- (en) Camacho JA, Obie C, Biery B, Goodman BK, Hu CA, Almashanu S. et al. « Hyperornithinaemia-hyperammonaemia-homocitrullinuria syndrome is caused by mutations in a gene encoding a mitochondrial ornithine transporter » Nat. Genet. 1999;22(2):151-8.
- (en) Rajantie J, Simell O, Rapola J, Perheentupa J. « Lysinuric protein intolerance: a two-year trial of dietary supplementation therapy with citrulline and lysine » J Pediatr. 1980;97(6):927-32.
- (en) Schwedhelm E, Maas R, Freese R, Jung D, Lukacs Z, Jambrecina A. et al. « Pharmacokinetic and pharmacodynamic properties of oral L-citrulline and L-arginine: impact on nitric oxide metabolism » Br J Clin Pharmacol. 2008;65(1):51-9.
- (en) Collins JK, Wu G, Perkins-Veazie P, Spears K, Claypool PL, Baker RA. et al. « Watermelon consumption increases plasma arginine concentrations in adults » Nutrition 2007;23(3):261-6.
- (en) Mandel H, Levy N, Izkovitch S, Korman SH. « Elevated plasma citrulline and arginine due to consumption of Citrullus vulgaris (watermelon) » J Inherit Metab Dis. 2005;28(4):467-72.
- (en) Basu HN, Liepa GU. « Arginine: a clinical perspective » Nutr Clin Pract. 2002;17(4):218-25.
- (en) Cynober L, Boucher JL, Vasson M-P. « Arginine metabolism in mammals » The Journal of Nutritional Biochemistry 1995;6(8):402-13.
- Andrew J. Chappell, Daniel M. Allwood, Rebecca Johns et Samantha Brown, « Citrulline malate supplementation does not improve German Volume Training performance or reduce muscle soreness in moderately trained males and females », Journal of the International Society of Sports Nutrition, vol. 15, (ISSN 1550-2783, PMID 30097067, PMCID 6086018, DOI 10.1186/s12970-018-0245-8, lire en ligne, consulté le )
- (en) Moinard C, Cynober « L. Citrulline: a new player in the control of nitrogen homeostasis » J. Nutr. 2007;137(6 Suppl 2):1621S-1625S.
- (en) Moinard C, et al. « Citrulline Supplementation Induces Changes in Body Composition and Limits Age-Related Metabolic Changes in Healthy Male Rats.» J Nutr. 2015;145(7):1429–37.
- (en) Bouillanne, O et al. « Impact of 3-week citrulline supplementation on postprandial protein metabolism in malnourished older patients: The Ciproage randomized controlled trial.» Clin. Nutr. 2019;38(2):564-574.
- (en) Osowska S, Duchemann T, Walrand S, Paillard A, Boirie Y, Cynober L, Moinard C. « Citrulline modulates muscle protein metabolism in old malnourished rats. » Am. J. Physiol. 2006;291:E582-6241.
- (en) Moinard C, Jourdan M, Walrand S, Cynober L. « Use of citrulline for treating undernutrition conditions. » Patent EP2081564, 2006.
- (en) Jourdan M, Nair KS, Carter RE, Schimke J, Ford GC, Marc J et al. « Citrulline stimulates muscle protein synthesis in the post-absorptive state in healthy people fed a low-protein diet - A pilot study. » Clinical Nutrition 2015;34(3):449–56.
- (en) Faure C, Raynaud-Simon A, Ferry A, Daugé V, Cynober L, Aussel C, Moinard C. « Leucine and citrulline modulate muscle function in malnourished aged rats. » Amino Acids 2012;42:1425-33.
- (en) Rougé C, Des Robert C, Robins A, Le Bacquer O, Volteau C, De La Cochetière M-F. et al. « Manipulation of citrulline availability in humans » Am. J. Physiol. Gastrointest. Liver Physiol. 2007;293(5):G1061-1067.
- (en) Buckinx F, Gouspillou G, Carvalho LP et al. « Effect of High-Intensity Interval Training Combined with L-Citrulline Supplementation on Functional Capacities and Muscle Function in Dynapenic-Obese Older Adults. » J Clin Med. 2018;7:561-575.
- (en) Buckinx F, Marcangeli V, Pinheiro Carvalho L et al. « Initial Dietary Protein Intake Influence Muscle Function Adaptations in Older Men and Women Following High-Intensity Interval Training Combined with Citrulline. » Nutrients. 2019. 11:1685-1704.
- (en) Crenn P, Coudray-Lucas C, Thuillier F, Cynober L, Messing B. « Postabsorptive plasma citrulline concentration is a marker of absorptive enterocyte mass and intestinal failure in humans » Gastroenterology 2000;119(6):1496-505.
- (en) Crenn P, Vahedi K, Lavergne-Slove A, Cynober L, Matuchansky C, Messing B. « Plasma citrulline: A marker of enterocyte mass in villous atrophy-associated small bowel disease » Gastroenterology 2003;124(5):1210-9.
- (en) Osowska S, Moinard C, Neveux N, Loï C, Cynober L. « Citrulline increases arginine pools and restores nitrogen balance after massive intestinal resection » Gut 2004;53(12):1781-6.
- Pascal Crenn, « Modélisation clinique et biochimique de l'insuffisance intestinale chronique chez l'homme. La concentration plasmatique veineuse post-absorptive de citrulline, marqueur de la masse entérocytaire absorptive », Université Paris-Diderot - Paris VII (thèse), (lire en ligne, consulté le )
- (en) Rhoads JM, Plunkett E, Galanko J, Lichtman S, Taylor L, Maynor A. et al. « Serum citrulline levels correlate with enteral tolerance and bowel length in infants with short bowel syndrome » J Pediatr. 2005;146(4):542-7.
- (en) Blijlevens NMA, Lutgens LCHW, Schattenberg AVMB, Donnelly JP. « Citrulline: a potentially simple quantitative marker of intestinal epithelial damage following myeloablative therapy » Bone Marrow Transplant. 2004;34(3):193-6.
- (en) Akashi K, Miyake C, Yokota A. « Citrulline, a novel compatible solute in drought-tolerant wild watermelon leaves, is an efficient hydroxyl radical scavenger » FEBS Letters 2001;508(3):438-42.
- (en) Bonnefont-Rousselot P, Raynaud-Simon A, Le Plénier S, Cynober L, Moinard C. « PP210 Citrulline Supplementation Is Efficient In Limiting Lipoprotein Oxidation In Healthy Aged Rats » Clinical Nutrition Supplements 2010;5(2):105.
- (en) Barr FE, Tirona RG, Taylor MB, Rice G, Arnold J, Cunningham G. et al. « Pharmacokinetics and safety of intravenously administered citrulline in children undergoing congenital heart surgery: potential therapy for postoperative pulmonary hypertension » J Thorac Cardiovasc Surg. 2007;134(2):319-26.
- (en) Smith HAB, Canter JA, Christian KG, Drinkwater DC, Scholl FG, Christman BW. et al. « Nitric oxide precursors and congenital heart surgery: a randomized controlled trial of oral citrulline » J Thorac Cardiovasc Surg. 2006;132(1):58-65.