Développement mosaïque
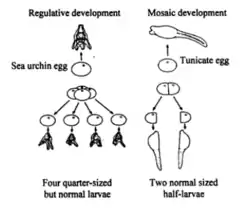
Le développement mosaïque est une théorie faisant partie de la biologie évolutive du développement. Selon elle, chaque cellule d'un embryon est à l’origine d’une partie bien précise de l'organisme, via des agents tels que des facteurs de transcription positionnés dans l'œuf par la mère[1]. Si une cellule est endommagée ou enlevée, elle ne pourra pas être remplacée ni compensée par une autre cellule qui serait reprogrammée. Un développement mosaïque implique que la division cellulaire de l’œuf et l’origine des différents types cellulaires sont prédéterminés et que toute déviation produirait un organisme défectueux. Dans un embryon totalement mosaïque, si on séparait les deux premiers blastomères, ils donneraient chacun un demi-embryon, pourvu que la distribution du matériel dans l’œuf soit normale. Dans le développement mosaïque, les cellules communiquent très peu entre elles, et la spécification cellulaire suit un patron rigide. En effet, chaque cellule a un sort prédéterminé et restrictif. On observe une spécification autonome lorsque la spécification d’une cellule est indépendante de ce qui l’entoure. Ceci est possible grâce à la ségrégation durant le clivage de déterminants cytoplasmiques tels que des ARN messagers et des protéines. La spécification autonome résulte en un patron de développement mosaïque[2].
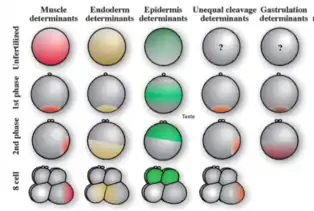
On a tendance à classer le développement d’embryons soit dans la catégorie mosaïque ou dans la catégorie régulateur, mais il s’avère que de nombreux organismes ont les deux types de développement. Les embryons mosaïques étaient au départ caractéristiques de nombreux vertébrés tels que les annélides et les arthropodes. Ce type de développement fut par la suite un critère de classification des animaux dans les sous-règnes et les super-phylum. Le développement mosaïque et le développement régulateur sont des termes employés pour illustrer les différences majeures dans le patron et le processus de développement à travers les différents groupes d’animaux. Les processus développementaux d’un organisme ne sont presque jamais totalement mosaïques ou régulateurs. Les différents comportements sont fréquemment observés dans un même organisme, mais à des moments différents au cours du développement. Lorsque c'est le cas, le développement régulateur se retrouve habituellement à la suite de la phase de développement mosaïque[2].
Historique
La théorie du développement mosaïque fut à une certaine époque, un réel sujet de débat entre différents chercheurs arrivant à des conclusions et donc des théories différentes. Les deux principaux chercheurs à l'origine de ce débat sont Edwin Conklin qui pensait que le développement était mosaïque et Hans Driesch qui pensait que le développement était régulateur. De nos jours, ce débat n'est plus nécessaire puisqu'on est parvenu à comprendre que le développement de plusieurs organismes n'est ni totalement mosaïque, ni totalement régulateur, mais plutôt une combinaison des deux.
- Vers 1850, les embryologistes essayaient de comprendre les mécanismes du développement sans vraiment porter attention à l’aspect génétique.
- En 1887, Laurent Chabry, un étudiant en médecine, étudiait les embryons d’ascidies. Lors d'une expérience, avec une aiguille, il a tué deux blastomères au stade de hut cellules. Les cellules non affectées ont formé un organisme sans queue et en mettant en culture les deux mêmes cellules que celles qui ont été tuées, il y a eu uniquement formation des muscles de la queue. Cette étude a conclu que les embryons d’ascidies sont hautement mosaïques avec des déterminants qui précisent le sort de chaque blastomère[1].
- Au début du XXe siècle, l’embryologiste Thomas Morgan a réalisé l’importance des gènes dans le processus développemental.
- En 1905, Edwin Conklin utilisa un pigment jaune dans une ascidie pour suivre l'origine des muscles de la queue pendant le développement. Le pigment est uniformément réparti avant la fertilisation. Après fertilisation, le pigment se retrouve dans le pôle végétal et puis par la suite, il se retrouve plus précisément dans le blastomère B4.1 qui est la région progénitrice des muscles de la queue. Il savait que le pigment jaune n'était pas le déterminant lui-même, mais il pensait que ce pigment lui permettrait de savoir où le déterminant responsable était[1].
- En 1995, Hans Driesch découvre à l'aide de Phallusia mammilata, que les blastomères jusqu'au stage de quatre cellules, peuvent donner naissance à la larve entière. Ce qui contredit la théorie du développement mosaïque et propose plutôt un développement régulateur. Cette hypothèse fut appuyée par une autre recherche menée par Crampton en 1997, mais cette fois-ci avec Molgula manhattensis[3].
- En 2001, Hiroki Nishida a identifié le déterminant responsable de la formation des muscles de la queue chez les ascidies qui est un facteur de transcription doigt de zinc appelé Macho-1. Macho-1 est au sommet d’une cascade de régulation qui conduit l’expression localisée d’un groupe de gènes à initier la différenciation d’un muscle. Ce qui illustre le développement mosaïque pour les muscles de la queue. Cependant, pour d'autres tissus tel que la notochorde, les interactions entre les cellules sont nécessaires pour la spécification et détermination des cellules[1].
Expériences sur les œufs d'ascidies
Les ascidies sont des organismes marins appartenant aux tuniciers qui fabriquent de la cellulose comme les plantes. Il s'avère que les tuniciers sont également de proches cousins évolutifs des vertébrés et des céphalochordés [4]. Les ascidies sont de bon modèles puisqu'il est possible de suivre les cellules individuelles jusqu'à leur entrée dans les organes de la larve [3]. Les embryons d'ascidies sont un bon modèle aussi parce qu'ils ont une simplicité cellulaire et une transparence qui permet l'utilisation de techniques d'imagerie plus avancées. Également, ils peuvent être pratique pour élucider la communication cellulaire dans les stades précoces de développement puisqu'ils ont un nombre limité de cellules et le mode de développement ne change pas [5]. Le développement des œufs d'ascidies se fait vraisemblablement suivant la théorie du développement mosaïque puisqu'il y a des substances situées à des endroits bien précis dans l'œuf qui permettent la formation d'organes. Déjà au début du développement des ascidies, on observe un degré de différenciation élevé. Tel que décrit dans l'article de Conklin[3], des substances sont reconnaissables dans l'œuf avant même la première division cellulaire. Ces substances donnent naissance soit aux cellules des muscles de la queue de la larve, du mésenchyme, de la chorde et de la plaque neurale, de l'endoderme ou encore de l'ectoderme. Après la première division, ces substances semblent occuper leur position définitive dans l'œuf d'ascidie [3].
Les embryons d'ascidies semblent être mosaïques, puisqu'ils ne vont pas compenser pour la perte d'une partie si on fait l'ablation de blastomères. La compétence à produire certains tissus est restreinte aux blastomères de ces tissus spécifiques. Les cellules ne sont pas totipotentes comme dans le développement régulateur. Selon Nishida, l'embryogenèse des ascidies semblent effectivement être mosaïque, mais il ne faut toutefois pas négliger le rôle des interactions entre les cellules dans le développement[5]. Dans les embryons d’ascidies, mais également dans les embryons de nématodes et de spiraliens, la détermination apparaît très tôt dans le développement et donc la capacité régulatrice est très basse, ce qui fait en sorte qu’une cellule enlevée ne pourra pas être remplacée ou être compensée par une autre cellule reprogrammée.
Des études développementales ont également été menées sur d'autres organismes que les ascidies tels que les cténophores, annélides, mollusques et amphibiens. La théorie du développement mosaïque serait donc applicable au moins comme étant une partie du développement de plusieurs organismes[3].
D'un point de vue évolutif
Tout d'abord, il importe de se demander dans le cadre de la biologie évolutive du développement, si l'embryologie précoce est relativement conservée ou variable dans le temps. Pour déterminer à quel moment la variation apparait dans le développement, il faut choisir un groupe taxonomique puisqu'il y a des différences à ce niveau entre les groupes. Dans les Deuterostomia et les Ecdysozoa, le développement est partiellement ou en totalité régulateur. Ce qui signifie que dans ces groupes, si une perturbation arrivait au début du développement, elle pourrait être réparée plus tard. Dans les Spiralia, les embryons ont beaucoup moins la capacité de faire la régulation et donc dans ce groupe, on retrouve le développement mosaïque tel que décrit par Conklin. En effet, chez les Spiralia, les cellules sont relativement indépendantes les unes des autres, elles ne communiquent pas très souvent ni très bien entre elles et la formation se fait selon un patron déterminé. Dans les embryons régulateurs, les cellules restent relativement totipotentes, ce qui signifie qu'elles peuvent changer leur fonction dans le développement tardif, une fois la gastrulation passée. Ceci s'avère impossible chez les embryons ayant un développement mosaïque [6].
Certains proposent que l'embryologie précoce de Spiralia est relativement conservée et que l'embryologie tardive est plus variable. Si cela s'avère, cela signifierait que l'embryologie précoce est plus susceptible à l'homologie tandis que l'embryologie tardive et la morphologie adulte seraient plus susceptible à l'homoplasie. Le timing lors de la division cellulaire précoce entre les différents groupes devrait donc montrer moins d'homoplasie que le timing dans la division tardive. En effet, les changements importants dans l'embryologie précoce semblent plutôt rares. On s'attend à ce que le timing de la formation cellulaire dans l'embryologie soit plus conservé au début du développement parce que la seule façon d'augmenter la variation dans le timing de la formation cellulaire est d'avoir un plus grand nombre de cellules qui peuvent indépendamment se diviser dans l'embryon, ce qui arrive plus tard dans le développement.
Certains pensent que c'est plutôt lors du stade phylotypique que la variation est réduite. Avant et après ce stade, la variation dans le timing et la position des cellules entre les taxons serait plus élevée. Contrairement au développement mosaïque, dans un développement régulateur, on peut penser qu'il y a plus de variations dans le timing de la formation cellulaire dans le développement précoce puisque les erreurs qui pourraient s'y produire ont la possibilité, comme mentionné précédemment, d'être corrigées plus tard durant la gastrulation. Spiralia a comme groupe-sœur les phoronidiens, brachiopodes et les bryozoaires qui ont un développement régulateur. La seule différence trouvée entre Spiralia et les phoronidiens est que chez ces derniers, lors du début du développement, le timing des cellules n'était pas synchronisé à la quatrième et cinquième division. Les brachiopodes et les bryozoaires aussi ont cette désynchronisation des divisions cellulaires. Il y aurait donc une corrélation entre la présence de division cellulaires non-synchronisées et un développement régulateur puisque le développement mosaïque dépend, pour la spécification des cellules, de la position mais également du timing, ce qui n'est pas le cas pour le développement régulateur[6].
Notes et références
- (en) Lawrence, P.A. and Levine, M, « Mosaic and regulative development: two faces of one coin », Current Biology, no 7, , p. 236-239
- (en) Thomson, K.S., Morphogenesis and Evolution, Oxford University Press, , p.29-31
- Conklin, « Mosaic Development in Ascidian Eggs », Journal of Experimental Zoology, , p. 145-223
- Lamy, C. et Lemaire, P., « Les embryons d'ascidies: De la naissance de l'embryologie à l'analyse des réseaux de gènes. », Medecine/Sciences, no 24, , p. 263-269
- (en) Nishida, H, « Specification of Embryonic Axis and Mosaic Development in Ascidians », Developmental Dynamics, no 233, , p. 1177-1193
- (en) Guralnick, R.P. and Lindberg, D.R., « Reconnecting cell and animal lineages: what do cell lineages tell us about the evolution and development of Spiralia? », International Journal of Organic Evolution, no 8, , p. 1501-1519