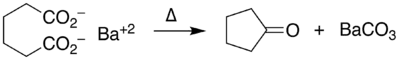Décarboxylation cétonique
La décarboxylation cétonique, aussi connue sous le nom de cétonisation, est une réaction organique de décarboxylation convertissant deux équivalents d'acide carboxylique en cétone symétrique par chauffage, dégageant un équivalent d'eau de dioxyde de carbone. Les bases favorisent cette réaction. Le mécanisme de réaction implique probablement une attaque nucléophile du carbone alpha d'un groupe acide sur le carbonyle de l'autre groupe acide, éventuellement par réaction concertée avec la décarboxylation. Un autre mécanisme a été proposé, avec formation initiale d'un carbanion intermédiaire en même temps que la décarboxylation d'un groupe d'acide avant l'attaque nucléophile, mais il est peu probable car le sous-produit résultant de la protonation du carbanion par l'acide n'a jamais été détecté[1].
Cette réaction est différente de la décarboxylation oxydative qui procède par un mécanisme radicalaire, et se caractérise par une distribution différente des produits dans les expériences avec marquage isotopique à partir de deux acides carboxyliques différents.
Avec deux acides carboxyliques différents, la réaction se passe mal en raison d'une mauvaise sélectivité, sauf lorsque l'un des acides (par exemple, un petit acide volatil) est utilisé en large excès.
Exemples
La distillation sèche de l'acétate de calcium en acétone est une réaction rapportée par Charles Friedel en 1858[2], et qui fut jusqu'à la Première Guerre mondiale la principale méthode commerciale de production de l'acétone[3].
La décarboxylation cétonique de l'acide propanoïque catalysé par l'oxyde de manganèse(II) dans un four tubulaire[4] produit la pentan-3-one. Cette dernière est également produite commercialement à partir de l'acide propanoïque, catalysé par l'oxyde de cérium(IV) et le dioxyde de manganèse sur de l'alumine. La nonan-5-one, composé potentiellement d'intérêt comme carburant diesel, peut être produite à partir de l'acide valérique, lui-même produit à partir du fructose[5].
Un exemple de cétonisation intramoléculaire est la conversion de l'acide adipique en cyclopentanone avec l'hydroxyde de baryum[6] :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ketonic decarboxylation » (voir la liste des auteurs).
- M Renz, « Ketonization of Carboxylic Acids by Decarboxylation: Mechanism and Scope », Eur. J. Org. Chem., vol. 2005, no 6, , p. 979–988 (DOI 10.1002/ejoc.200400546)
- C. Friedel, « Ueber s. G. gemischte Acetone », Annalen der Chemie und Pharmacie, vol. 108, , p. 122–125 (DOI 10.1002/jlac.18581080124, lire en ligne)
- E. R. Squibb, « Improvement in the Manufacture of Acetone.1 », Journal of the American Chemical Society, vol. 17, no 3, , p. 187–201 (DOI 10.1021/ja02158a004, lire en ligne)
- Furniss, Brian, Hannaford, Antony, Smith, Peter et Tatchell, Austin, Vogel's Textbook of Practical Organic Chemistry 5th Ed., London, Longman Science & Technical, (ISBN 9780582462366, lire en ligne), 613
- Filoklis D. Pileidis et Maria-Magdalena Titirici, « Levulinic Acid Biorefineries: New Challenges for Efficient Utilization of Biomass », ChemSusChem, vol. 9, no 6, , p. 562–582 (PMID 26847212, DOI 10.1002/cssc.201501405, lire en ligne)
- J. F. Thorpe et G. A. R. Kon, « Cyclopentanone », Org. Synth., vol. 5, , p. 37 (DOI 10.15227/orgsyn.005.0037)