Cyanate de potassium
Le cyanate de potassium est un composé ionique de formule brute KNCO. Il s'agit d'un sel de l'ion potassium K+ avec la base conjuguée NCO− de l'acide isocyanique HNCO. Il est utilisé notamment dans la fabrication d'herbicides et comme matière première pour la synthèse de nombreux composés organiques azotés tels que des dérivés de l'urée, des semicarbazides, des carbamates et des isocyanates ; on l'utilise également en métallurgie dans le traitement thermique de certains métaux.
| Cyanate de potassium | |
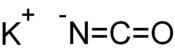 Structure ionique du cyanate de potassium |
|
| Identification | |
|---|---|
| Nom UICPA | cyanate de potassium |
| No CAS | [1] |
| No ECHA | 100.008.798 |
| No CE | 209-676-3 |
| PubChem | 11378442 |
| ChEBI | 38904 |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche |
| Propriétés chimiques | |
| Formule | KOCN |
| Masse molaire[2] | 81,115 1 ± 0,001 4 g/mol C 14,81 %, K 48,2 %, N 17,27 %, O 19,72 %, gmol·-1 |
| Propriétés physiques | |
| T° fusion | 315 °C [1] |
| Solubilité | 75 g·100cm-3 [1] |
| Précautions | |
| SGH[3] | |
 Attention |
|
| NFPA 704[1] | |
| Inhalation | Peut causer une irritation des voies respiratoires. Les symptômes peuvent inclure la toux et l'essoufflement[1]. |
| Peau | Peut causer une légère irritation et rougeur[1]. |
| Yeux | Peut causer des irritations, des rougeurs et des douleurs[1]. |
| Ingestion | De fortes doses peuvent causer des vomissements, excitation cérébrale, faiblesse et une somnolence[1]. |
| Unités du SI et CNTP, sauf indication contraire. | |
On le prépare par action de l'urée (NH2)2CO sur le carbonate de potassium K2CO3 à 400 °C :
Cette réaction produit un liquide contenant des intermédiaires et des impuretés parmi lesquelles du biuret, de l'acide cyanurique, de l'allophanate de potassium KO2CNHC(O)NH2 et de l'urée qui n'a pas réagi, mais toutes ces espèces sont instables à 400 °C.
Notes et références
- « Avantor is setting science in motion for a better world », sur VWR (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
