Conservatisme de niche
La phylogénie est l'étude des relations de parenté entre les êtres vivants et permet l'inscription des espèces dans une histoire évolutive et leur regroupement en groupes taxonomiques. Cette histoire joue un rôle fondamental dans la détermination des niches écologiques de chaque espèce et l'étudier nous permet de comprendre comment les différents mécanismes évolutifs existants ont permis la répartition actuelle des espèces dans leur niche écologique. Elle propose ainsi des hypothèses sur le rôle du conservatisme de niche dans la spéciation et le maintien de la diversité spécifique.
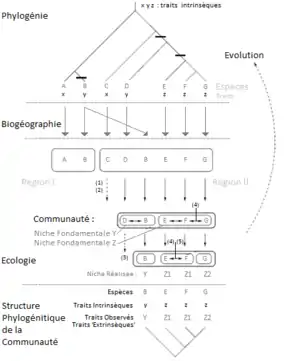
La mise en relation des données évolutives et des données écologiques, impliquant les traits phénotypiques et les données moléculaires d'une espèce, bien que plus utilisée aujourd'hui qu'au siècle dernier, n'est pas un concept nouveau. Déjà, Darwin, dans "L'Origine des espèces" évoquait le fait que des espèces appartenant à un même genre et donc proches phylogénétiquement puissent présenter des conditions de vie et de ressources similaires indiquant ainsi qu'il existe très probablement un lien entre phylogénie et écologie :
« Les espèces appartenant au même genre ont presque toujours, bien qu'il y ait beaucoup d'exceptions à cette règle, des habitudes et une constitution presque semblables; la lutte entre ces espèces est donc beaucoup plus acharnée, si elles se trouvent placées en concurrence les unes avec les autres, que si cette lutte s'engage entre des espèces appartenant à des genres distincts. »
— Charles Darwin, "L'Origine des espèces"
Aujourd'hui, il existe un grand nombre de méthodes permettant la mise en relation des données écologiques et des données évolutives afin de trouver les niches écologiques de certaines espèces. Les recherches et les études appliquées au rôle de la phylogénie dans la détermination de la niche écologique considèrent le terme "niche écologique" selon la définition donnée par G.E. Hutchinson en 1957. Ici, la niche écologique correspond donc à l'ensemble des conditions et des ressources où une espèce donnée survit, en l'absence (niche fondamentale) ou en présence (niche réalisée) des interactions écologiques telles que la compétition ou le mutualisme.
Conservatisme de niche (PNC)
Le conservatisme de niche écologique correspond à la similarité écologique entre des espèces apparentées[2]. Par ailleurs, la tendance des lignées à conserver les caractéristiques des niches écologiques au cours du temps et des événements de spéciation est définie comme le conservatisme phylogénétique de la niche écologique [3] - [4]. Actuellement, il existe un débat au sein de la communauté scientifique pour savoir si le conservatisme phylogénétique de la niche (PNC : Phylogenetic Niche Conservatism) est un processus évolutif (issu de l'anglais : "process") notamment impliqué dans la structure des communautés ou une conséquence de processus évolutifs (issu de l'anglais : "pattern")[5]. Ce phénomène de conservatisme de niche est dépendant de deux conditions majeures : un trait inhérent à la niche écologique des organismes et héritable[6].
Les effets du PNC
Le conservatisme phylogénétique de la niche a plusieurs conséquences sur l'évolution des espèces. Dans cette partie, le conservatisme de niche est considéré comme un processus évolutif en lui-même.
Spéciation allopatrique et vicariance
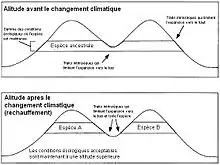
Lors de changement climatique, il peut y avoir déplacement géographique des niches écologiques. Dans ce cas, plutôt que de rester sur place et de s'adapter aux nouvelles conditions climatiques de leur milieu, les espèces préfèrent suivre le déplacement de leur niche
qui requiert moins d’efforts que l’adaptation, protégeant l’espèce d’une baisse de sa fitness.
Cela s’observe très bien avec le phénomène de la vicariance. La vicariance est l’apparition d’une barrière géographique entre des populations d'une espèce. Cette barrière correspond à des conditions suboptimales pour l'espèce. S'il y a conservatisme de la niche, les individus d’une même espèce vont se retrouver séparés car ils n'auront pas pu s’adapter aux conditions de cette barrière[7]. Il y aura arrêt des flux de gènes entre ces deux populations qui, à terme, formeront deux espèces distinctes. Si l'espèce est capable d'étendre sa niche aux conditions de la barrière, cet isolement par arrêt de flux de gène ne se produira pas[8].
Par exemple, pour une population vivant au niveau d’un col de montagne, l’espèce se répartit sur tout le niveau correspondant à cette altitude, à la fois sur la montagne et dans le col. Si, lors d’un changement de conditions climatiques, le lieu où se trouve cette espèce se réchauffe, l'espèce va se déplacer dans les hauteurs de la montagne afin de retrouver un climat plus froid, correspondant à sa niche écologique. Le col correspondra désormais à une zone avec des conditions suboptimales, car sera une zone trop chaude pour l’espèce. Le col va séparer l’espèce en deux espèces A et B, car l'espèce n'aura pas pu s'adapter à une température plus chaude en raison du conservatisme de la niche[7].
La biogéographie
Les arbres phylogénétiques mettent souvent en évidence une certaine constante écologique entre clades. Cette constance écologique peut avoir un impact sur la répartition géographique des espèces, il est donc possible de chercher des explications à cette répartition dans les phylogénies[9]. C'est ce que fait la biogéographie: utiliser la phylogénie pour expliquer la répartition géographique des espèces. Elle permet d'expliquer notamment pourquoi des espèces sont présentes dans certaines zones géographiques et pas dans d'autres qui leur sont attenantes.
Le fait que la niche écologique impose des conditions climatiques particulières à l'espèce est important pour la biogéographie de nombreux clades. En effet, la spécialisation climatique de la niche va contraindre les espèces à se répartir dans des zones géographiques restreintes, où ces conditions sont retrouvées. Lorsque cette répartition atypique est constatée chez des espèces anciennes, cela suggère que la niche écologique de cette espèce est conservée depuis longtemps. Le conservatisme climatique de la niche est donc à l'origine d'une répartition géographique particulière des espèces[8].
L'utilisation de la biogéographie peut-être intéressante pour prévoir les aires de répartition potentielle d'espèces invasives. Si le conservatisme de la niche, considéré d'un point de vue climatique, limite l'expansion des espèces hors de leur niche fondamentale (ensemble des conditions où l'espèce peut maintenir un taux de croissance intrinsèque supérieur à 1), on s'attend à une relation entre la distribution climatique des espèces invasives et les conditions climatiques de leur zone d'origine. Au contraire, si des espèces se répandent dans des zones où le climat ne correspond pas à leur région originelle, d'autres mécanismes comme la compétition seront plus importants que la biogéographie[8].
Structure des communautés
En écologie, une communauté est composé de populations occupant un ensemble de niches écologiques.
Le conservatisme de la niche a un impact sur la structure des communautés, notamment en limitant la dispersion des lignées, c'est-à-dire le départ d'un organisme de son lieu de naissance vers un nouveau lieu de reproduction voire de colonisation. Également, le conservatisme de le niche réduit la variation de leurs traits écologiques entre les différentes régions où elles évoluent[8] - [10].
La structure phylogénétique de la communauté est utilisée pour clarifier les processus déterministes et les règles d’assemblage d’une communauté.
Un facteur dominant lié à la phylogénie et impliqué dans la structure de l’assemblage non-aléatoire des espèces dans une communauté est le filtrage environnemental. Ce filtrage met en évidence les regroupements phylogénétiques. C’est un facteur visible lorsque des espèces sympatriques sont plus apparentées que ne le prévoit le hasard, en partageant un trait en commun qui a été conservé, par exemple dans la tolérance physiologique à leur environnement[8] - [10].
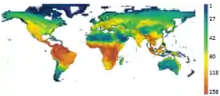
Un autre facteur influant la structure des communautés est le gradient latitudinal des espèces. Cette gradation latitudinale correspond à une diversité spécifique importante dans les régions tropicales et qui décroit avec la latitude dans les régions tempérées puis froides. L'hypothèse du conservatisme tropical est une théorie qui peut expliquer cette gradation latitudinale. Elle repose sur trois hypothèses :
- les régions tropicales sont plus anciennes que les autres, donc les espèces qui s'y trouvent sont également plus anciennes et ont eu plus de temps pour s'adapter et se diversifier ;
- dans les temps géologiques récents, les zones tropicales étaient plus étendues, ce qui explique que les taxons les plus abondants soient originaires des tropiques ;
- les espèces originaires des régions tropicales vont rarement se disperser dans les régions tempérées à cause du conservatisme de leur niche, qui rend difficile leur adaptation à ces nouvelles conditions climatiques.
Ces trois hypothèses sont des hypothèses de structuration des communautés. La gradation latitudinale de la diversité des espèces peut donc s'expliquer en partie par le conservatisme de la niche. Les zones tempérées ont une richesse spécifique plus faibles que les zones tropicales car les espèces tropicales ne peuvent pas se disperser dans les zones tempérées; Cependant, ce phénomène seul ne peut pas tout expliquer car il prévoit l'absence d'espèces dans les régions tempérées, ce qui n'est pas le cas[1] - [8].
Mécanismes supportant le PNC
Si le conservatisme phylogénétique de la niche est parfois contesté au sein de la communauté scientifique, il est possible de discuter de processus directs et indirects supportant ce conservatisme.
Sélection naturelle stabilisante
La sélection naturelle stabilisante est considérée comme le facteur principal appuyant ce phénomène de conservatisme de niche au cours du temps. En effet, si des conditions environnementales alternatives entraînent une diminution de la fitness ou de la croissance de la population (donc modifient leur niche écologique), la sélection naturelle va favoriser des traits qui maintiennent les individus dans leur niche originelle[12] - [13]. C’est notamment le cas lors des processus de sélection comportementale de l’habitat. Les organismes vont consciemment éviter les habitats où leurs capacités de survie et de reproduction seront réduites, dans un objectif de maximisation de la fitness[14]. A l’échelle du microhabitat, les ressources les mieux adaptées vont être choisies par certains organismes, si bien que certaines espèces vont se spécialiser à l'utilisation ou la consommation d'un type de ressources particulier. L'adaptation à des ressources différentes pourra donc s'avérer difficile.
Flux de gènes
Les flux de gènes peuvent également empêcher une évolution de la niche, notamment dans les petites populations dont la répartition est limitée par des conditions environnementales défavorables.
Dans le cas d'espèces à mobilité importante, une partie des individus va se retrouver à la limite de l'aire de répartition, donc en contact avec des conditions environnementales non optimales. Les gènes issus de la source (centre de l'aire de répartition) et apportés par des individus dispersants vont réduire la possibilité d'adaptation à ces conditions. Ces flux de gènes limitent l'adaptation à de nouvelles conditions environnementales et causent donc du conservatisme de niche[15]. Les flux de gènes issus de la source ne permettent pas aux individus "puits" de s'adapter.
Pléiotropie et Compromis évolutifs
L’évolution de la niche peut être influencée par une sélection antagoniste liée aux compromis évolutifs (trade-off) entre traits. En effet, certains traits permettant d'augmenter l'aire de répartition des individus semblent également réduire la fitness.
On parle également de traits à effet pléiotrope, correspondant à deux traits liés génétiquement. Si deux traits sont génétiquement liés, toute modification de la moyenne du premier trait, sous l’effet d’une sélection par exemple, se répercute sur la moyenne du second : si la corrélation est positive, les caractères évoluent dans le même sens, si elle est négative, les caractères évoluent en sens opposé (pléiotropie).
C’est notamment le cas chez une espèce de drosophile australienne (Drosophila serrata), pour laquelle l’augmentation de la répartition dans les régions froides-tempérées serait limitée par le fait que l’évolution de la résistance au froid est liée génétiquement à une diminution de la fécondité[16].
D'autres trade-off peuvent avoir le même effet. Dans le cas des plantes ligneuses, le diamètre des vaisseaux de xylème est issu d'un compromis entre la circulation de la sève permettant la photosynthèse et la résistance aux épisodes de gel-dégel. Ce trait limite la dispersion de ces plantes dans les régions froides-tempérées[17] - [6].
Manque de variabilités sur un trait
Un manque de variabilité sur un trait peut restreindre les possibilités de modifications de la niche écologique[18]. Il ne s’agirait pas d’une explication universelle au conservatisme de niche[19]. Cependant, ce processus peut constituer une hypothèse majeure dans l’explication des phénomènes de conservatisme, notamment lorsqu’il est observé sur des traits d’importance écologique majeure[20].
Méthodes mettant en évidence le PNC
Il existe 3 principes principaux mettant en évidence le conservatisme phylogénétique de la niche écologique.
Maintien de la niche (« niche retention »)
Les niches des ancêtres et de leurs descendants directs sont davantage similaires que ce qui serait attendu sous le modèle du mouvement brownien. Dans certains cas, les ancêtres et les descendants peuvent avoir des niches écologiques quasi identiques. Le maintien de la niche peut être le résultat de la sélection stabilisante et de diverses contraintes évolutives comme celles imposées par les facteurs génétiques, développementaux ou physiologiques[21].
Deux tests sont utilisables dans l'étude du maintien de la niche :
- Le test de Blomberg : un modèle où K est la mesure de la force du signal phylogénétique. K est une valeur qui varie entre 0 et 1. Ainsi, plus la valeur de K tend vers 1, plus les espèces sont apparentées phylogénétiquement. Dans le cas où K>1, cela indique une plus forte similarité du trait entre les espèces que ne le voudrait le hasard.
- Le test de Pagel δ, où δ permet d’estimer les changements du traits au cours du temps. Dans le cas où δ<1, le trait change rapidement au début de l’histoire d’un clade, puis ralentit avec le temps, preuve du conservatisme de niche. Lorsque δ>1, le changement du trait se fait plus tardivement et augmente au fil du temps[21] - [22] - [23].
Colonisation et déplacement de la niche ("niche filling" et "niche shifting")
Deux principes antagonistes sont distinguables dans l’évolution de la niche écologique :
La colonisation est un processus dans lequel, au fil de l’évolution, des espèces colonisent de nouvelles niches, ce qui implique une réduction de la distance phénotypique entre espèces apparentées de l’ancienne et de la nouvelle niche au fil du temps. Les niches des nouvelles espèces diffèrent moins des niches de leurs ancêtres.
En modélisation, ce principe est désigné par le terme « niche filling » (pouvant être traduit par : remplissage de la niche »).
Le déplacement de la niche est un cas où les espèces évoluent simultanément avec leur niche. Les niches des nouvelles espèces diffèrent de celles de leurs ancêtres.
En modélisation, ce principe est désigné par le terme « niche shifting » (pouvant être traduit par : déplacement de niche).
Deux types de tests peuvent être réalisés pour détecter une preuve du PNC :
- Le test de Pagel δ, vu précédemment. Dans le cas où δ<1, cela soutient l’hypothèse d’un remplissage de niche et correspond à la diminution du changement du trait au fil du temps[21].
- Le test de randomisation de Freckleton et Harvey est un test prenant les données d’un trait dans un arbre phylogénétique et permettant de calculer la variance du trait étudié. Cela permet de réaliser une estimation des différences distribuées aléatoirement dans l’arbre choisi. Il s’agit ensuite de mesurer la variance et la covariance de chaque trait répliqué. La variance du trait répliqué est comparée à celle du trait observé. Si cette variance est plus faible que ne le voudrait le hasard, alors il y a peu de différences entre les parents et la descendance d’une même espèce. Dans le cas où la variance est plus grande que prédit par le hasard, cela indique un déplacement de niche, la descendance présente des différences avec leurs ancêtres[21] - [24].
Inertie Phylogénétique
L’inertie phylogénétique se traduit par un retard dans le changement d’un trait par rapport à la vitesse de changement d’un facteur biotique ou abiotique (une modification de l’environnement, par exemple). De ce fait, les espèces mettent du temps pour atteindre le nouvel optimum pour un trait considéré, dans un environnement modifié.
L'inertie phylogénétique peut être détecté en utilisant un modèle évolutif appelé processus d'Ornstein-Uhlenbeck. Ce modèle permet de démontrer que les traits évoluent vers un phénotype optimal évoluant sous le mouvement brownien (de manière aléatoire)[22].
On étudie le taux évolutif pour quantifier l’inertie phylogénétique.
En effet, ce modèle permet de tester l’hypothèse qu’un taux évolutif faible au sein d’un clade rend compte du conservatisme de niche.
Deux estimations sont envisageables pour étudier le taux évolutif[21] :
- L’estimation de Θ, un paramètre qui mesure le rapport entre le taux évolutif d’un trait sur les branches d’un clade par rapport aux branches d’un autre clade[25].
- L’estimation du paramètre σ2, correspondant à la vitesse à laquelle un trait partagé entre espèces apparentées diverge au cours du temps[26].
Modification de la niche
Dérive génétique (modèle null)
La dérive génétique est un processus montrant que les espèces héritent de la niche écologique de leur ancêtre commun, puis divergent et évoluent de manière aléatoire au cours du temps. Les différences de traits entre les espèces s’accumulent au fil du temps selon le modèle de mouvement brownien (au hasard)[21].
Selon Blomberg (2001)[22], la notion de signal phylogénétique décrit que deux espèces ont des caractères d’autant plus similaires que leur ancêtre commun est récent [2].
Il existe deux types de tests permettant de voir si les traits de la niche évoluent selon le modèle de mouvement brownien [27] :
- Le test de Pagel δ, un paramètre permettant de mesurer l’apparentement entre espèces. La valeur de δ varie entre 0 et 1, plus δ s’approche de 1, plus les traits partagés entre les espèces évoluent de manière aléatoire.
- Le test de Blomberg, vu précédemment.
Par exclusion compétitive
D'un point de vue évolutif, ça demande moins d'efforts pour une population de se déplacer avec sa niche lorsque celle-ci se déplace plutôt que de rester sur place et de s'adapter aux nouvelles conditions climatiques de son milieu. Cependant, il n'est pas toujours possible pour l'espèce de se déplacer. Il lui arrive d’être confrontée à de l’exclusion compétitive inter-espèces[27] : l'espèce se retrouve exclue de sa niche et devra donc s’adapter à un nouvel environnement, à de nouvelles ressources et survivre dans un environnement dans lequel elle n’est pas apte. Cette espèce de s’adapter à un nouvel environnement via la sélection des gènes permettant une meilleure fitness dans les nouvelles conditions environnementales, c'est la sélection naturelle. C’est ainsi qu’apparaissent sur l’arbre phylogénétique les « pas évolutifs ». Cette espèce qui a dû s’adapter à un nouvel environnement devient une nouvelle espèce. Cette adaptation se fait généralement par la perte ou l’apparition d’un caractère pour s’adapter à sa nouvelle niche.
Par exemple, l’ancêtre des champignons serait une simple forme aquatique avec des spores flagellés mais, au cours de l’évolution, il y aurait eu disparition du caractère "spores flagellés", permettant d’étendre l’aire de répartition des champignons au milieu terrestre[28]. La disparition de ce caractère aurait donc entraîné une modification de la niche écologique de ces espèces. Les hypothèses faites concernant cette perte de flagelle sont que les individus avec des cellules flagellées seraient un groupe frère au sein des champignons n’ayant pas de cellules flagellées, induisant que cette perte du flagelle coïncide avec une adaptation à un environnement terrestre. L'affinement de cette adaptation au milieu terrestre se caractérise par la présence de deux nouveaux caractères qui sont le fruit de l'évolution des espèces de champignons en milieu terrestre : la croissance de filament et la dispersion aérienne des spores[28].
Par évolution rapide
Lorsque l'arrivée d'individus d'une espèce dans un nouvel habitat cause des modifications telles dans la survie et la reproduction de ces individus que la population est contre sélectionnée dans cet environnement, cela favorise le conservatisme de la niche. Cependant, si la survie et la reproduction ne sont affectées à un taux permettant la survie dans cette nouvelle niche, la niche de l’espèce va changer car l'espèce va pouvoir s'adapter à ces nouvelles conditions[2]. Parfois, cette évolution est rapide, c'est-à-dire qu'elle se produit à des échelles de temps comparables à celles considérées en écologie (classiquement, l'évolution s'étudie sur une échelle de temps du millier d'années et l'écologie sur une échelle de la centaine d'années[29]
Ces évolutions rapides sont fortement documentées L'évolution rapide dans le cadre des interactions hôtes-parasites est un bon exemple des changements de niches. Lorsqu'un hôte développe un mécanisme de résistance à un parasite, cette résistance entraîne une modification de la niche écologique du parasite. Le parasite répond à cette modification par le développement d'une contre-résistance. Il s'adapte donc de façon rapide à sa nouvelle niche[30]. Ce double phénomène va ainsi se répéter en boucle, selon l'hypothèse de la reine rouge, modifiant toujours la niche écologique du parasite.
Similarités de la niche écologique sans lien phylogénétique
Des similarités de niche écologique entre espèces éloignées phylogénétiquement peuvent exister malgré le fait que ces espèces aient un ancêtre commun relativement éloigné[1].
Une niche écologique est également caractérisé par de nombreux réseaux trophiques spécialisés à cette niche[31]. Les espèces faisant partie de cette chaîne ne sont pas forcément liées phylogénétiquement. Les données sur ce sujet restent encore très pauvres mais il y a néanmoins plusieurs mécanismes pouvant expliquer cela. Avant tout, les chaines trophiques sont présentes dans tous les milieux, mêmes les milieux natifs, s'ajoute ensuite à cela le cas de la migration, du déplacement d'une espèce qui peut être dû au fait que l’espèce soit spécialiste, c'est-à-dire, spécialiste d’un seul type de ressource alimentaire. Par exemple, le changement climatique peut faire migrer la proie d’une espèce prédatrice dans une autre niche qui lui sera adaptée. Les prédateurs de cette proie se voient alors dans l’obligation de la suivre et se retrouvent ainsi faisant partie d’une niche sans raison phylogénétique mais à cause de leur place dans le réseau trophique.
Mais les espèces généralistes, c'est-à-dire, les espèces pouvant se nourrir de plusieurs types de ressources, sont aptes à vivre plus facilement dans une autre niche ce qui peut faciliter la dispersion pour des raisons de reproduction par exemple[32].
Et enfin, il est possible de constater également que lors d'une exclusion compétitive, l'espèce qui se trouve exclue est forcée à s'habituer à un nouvel environnement, et se trouve alors dans une nouvelle niche sans avoir de liens phylogénétiques avec les autres individus de cette niche[27].
Annexes
Notes et références
- (en) Campbell O. Webb, David D. Ackerly, Mark A. McPeek et Michael J.Donoghue, « Phylogenies and Community Ecology », Annual Review of Ecology, Evolution, and Systematics, vol. 33, , p. 475-505
- (en) Peter B. Pearman, « Niche dynamics in space and time », Trends in Ecology and Evolution, vol. 23, , p. 149-158
- (en) N. Cooper, R. P. Feckleton et W. Jetz, « Phylogenetic conservatism of environmental niches in mammals », Proceedings of the Royal Society, vol. 278, , p. 2384–2391
- (en) John J. Wiens et al., « Niche conservatism as an emerging principle in ecology and conservation biology », Ecology Letters, vol. 13, , p. 1310-1324
- (en) François Chapleau, Peter H. Johansen et Mark Williamson, « The Distinction between Pattern and Process in Evolutionary Biology: The Use and Abuse of the Term 'Strategy », Oikos, no 53, , p. 136-138 (lire en ligne)
- (en) Michael D. Crisp et Lyn G. Cook, « Phylogenetic niche conservatism: what are the underlying evolutionary and ecological causes? », New phytologist, vol. 196, , p. 681-694 (DOI 10.1111/j.1469-8137.2012.04298.x)
- (en) John J. Wiens, « SPECIATION AND ECOLOGY REVISITED: PHYLOGENETIC NICHE CONSERVATISM AND THE ORIGIN OF SPECIES », Evolution, vol. 58(1), , p. 193-197
- (en) John J. Wiens et Catherine H. Graham, « Niche Conservatism: Integrating Evolution, Ecology, and Conservation Biology », Annual Review of Ecology, Evolution, and Systematics, , p. 519-539
- (en) Wiens JJ et Donoghue MJ, « Historical bio-geography, ecology, and species richness », Trends in Ecology and Evolution, vol. 19, , p. 639:644
- (en) J. Cavender-Bares, K. H. Kozak, P. V. A. Fin et S. W. Kembel, « The merging of community ecology and phylogenetic biology », Ecology Letters, vol. 12, , p. 693–715
- (en) L. B. Buckley et al., « Phylogeny, niche conservatism and the latitudinal diversity gradient in mammals », Proc. R. Soc. B, vol. 277, , p. 2131-2138
- (en) R.D. Holt, « Demographic constraints in evolution: towards unifying the evolution ary theories of senescence and niche conservatism », Evolutionary Ecology, vol. 10, , p. 1-11
- (en) R.D. Holt et M.S. Gaines, « Analysis of adaptation in heterogeneous landscapes: implications for the evolution of fundamental niches », Evolutionary Ecology, vol. 6, , p. 433-447
- (en) R.D. Holt et M. Barfield, « Habitat selection and niche conservatism », Israel Journal of Ecology & Evolution, vol. 54, , p. 295-309
- (en) M. Kirkpatrick et N.H. Barton, « Evolution of a species range », The American Naturalist, vol. 150, , p. 1-23
- (en) N.L. Jenkins et A.A. Hoffman, « Limits to the southern border of Drosophila serrata: cold resistance, heritability, and trade-offs », Evolution, vol. 53, , p. 1823-1834
- (en) Choat b., « Xylem traits mediate a trade-off between resistance to freeze–thaw-induced embolism and photosynthetic capacity in overwintering evergreens », New Phytologist, , p. 996–1005
- (en) A.D. Bradshaw, « Genostasis and the limits to evolution », Philos. Trans. R. Soc. Lond. B, vol. 333, , p. 289-305
- (en) D.D. Ackerly, « Community assembly, niche conservatism, and adaptive evolution in changing environments », Int. J. Plant Sci, vol. 164 (Suppl.), , p. 165-184
- (en) M.A. Geber et L.R. Griffen, « Inheritance and natural selection on functional traits », Int. J. Plant Sci., vol. 164 (Suppl.), , p. 21-42
- (en) N. COOPER, W. JETZ et R. P. FRECKLETON, « Phylogenetic comparative approaches for studying niche conservatism », Journal of Evolutionary Biology, vol. 23, , p. 2529–2539
- (en) T. Munkemuller et al., « How to measure and test phylogenetic signal », Methods in Ecology and Evolution, vol. 3, , p. 743-756
- (en) M. Pagel, « Inferring the historical patterns of biological evolution », Nature, vol. 401, , p. 877-884
- (en) R.P. Freckleton et P.H. Harvey, « Detecting non-Brownian trait evolution in adaptive radiations », PLoS Biol, vol. 4, , p. 2104-2111
- (en) G.H. Thomas, R.P. Freckleton et T. Szekely, « Comparative analyses of the influence of developmental mode on phenotypic diversification rates in shorebirds », Proc. R. Soc. B. Biol. Sci, vol. 273, , p. 1619-1624
- (en) E. Paradis, J. Claude et K. Strimmer, « APE: analyses of phylogenetics and evolution in R language », Bioinformatics, vol. 20, , p. 289-290
- (en) Catherine H. Graham, Santiago R. Ron, Juan C. Santos et Christopher J. Schneider, « Integrating Phylogenetics and Environmental Niche Models to Explore Speciation Mechanisms in Dendrobatid Frogs », Evolution, vol. 58, , p. 1781–1793 (ISSN 1558-5646, DOI 10.1111/j.0014-3820.2004.tb00461.x, lire en ligne, consulté le )
- (en) Timothy Y. James, Frank Kauff, Conrad L. Schoch et P. Brandon Matheny, « Reconstructing the early evolution of Fungi using a six-gene phylogeny », Nature, vol. 443, , p. 818–822 (ISSN 0028-0836, DOI 10.1038/nature05110, lire en ligne, consulté le )
- John N Thompson, « Rapid evolution as an ecological process », Trends in Ecology & Evolution, vol. 13, no 8, , p. 329–332 (DOI 10.1016/s0169-5347(98)01378-0, lire en ligne)
- (en) E. Decaestecker et al., « Host–parasite 'Red Queen' dynamics archived in pond sediment », Nature, vol. 450, , p. 870-873
- (en) George Sugihara, Louis-Félix Bersier, T. Richard E. Southwood et Stuart L. Pimm, « Predicted correspondence between species abundances and dendrograms of niche similarities », Proceedings of the National Academy of Sciences, vol. 100, , p. 5246–5251 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.0831096100, lire en ligne, consulté le )
- Jerzy Kolasa et David Strayer, « Patterns of the Abundance of Species: A Comparison of Two Hierarchical Models », Oikos, vol. 53, , p. 235–241 (DOI 10.2307/3566068, lire en ligne, consulté le )